Первый закон термодинамики является одним из основных законов. Этот закон является частным случаем всеобщего закона сохранения и превращения энергии. Этот закон устанавливает эквивалентность теплоты и работы. Согласно этому закону в изолированной системе сумма всех видов энергии постоянна, причём теплота и работа взаимно преобразуясь находятся в одном и том же количественном состоянии. Это впервые доказал английский физик
 Джоуль на опытной установке, схема которой приведена на рис. 3.
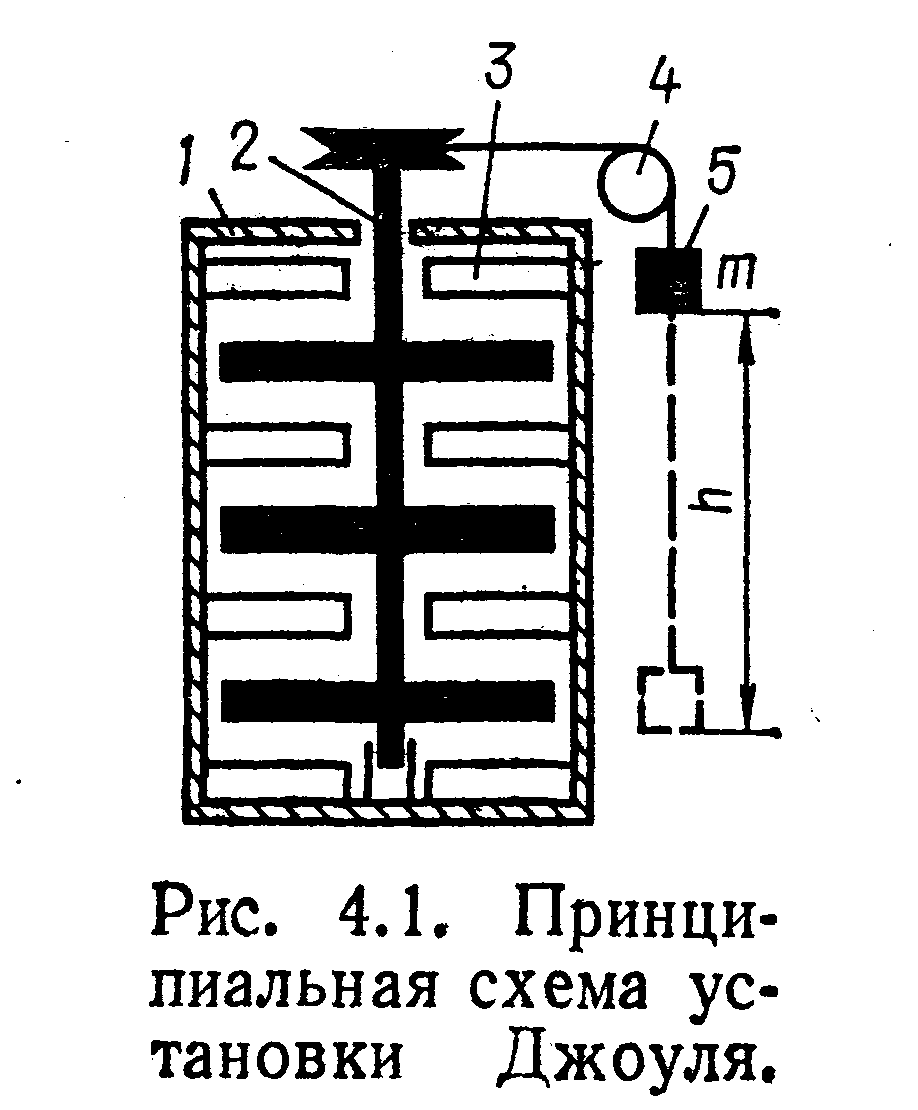
Джоуль на опытной установке, схема которой приведена на рис. 3.
Рис. 3 Принципиальная схема установки Джоуля.
Установка состояла из медного сосуда 1, тщательно теплоизолированного, мешалки 2, блока 4 и груза 5 массой т, связанного с мешалкой тросом, перекинутым через блок 4. На мешалке и внутренних стенках сосуда были закреплены лопатки 3. Сосуд заполнялся водой, масса которой была заранее известна. Груз использовался для привода во вращение мешалки. При этом, опускаясь на высоту h, он производил работу l=mh, равную убыли потенциальной энергии груза. Температура воды в сосуде измерялась термометром. Теплота, выделявшаяся в сосуде с водой, определялась по повышению температуры воды. В результате серии опытов Джоулем была получена зависимость
|
|
|
Q = AL,
в которой коэффициент пропорциональности А имел одно и то же значение не зависимо от способа получения теплоты, вида работы и температуры тела.
Таким образом, было показано, что количество полученной теплоты эквивалентно затраченной работе. Коэффициент пропорциональности А в уравнении называется тёпловым эквивалентом работы. Величина его соизмерима единицам измерения теплоты и работы.
Существует несколько формулировок первого закона термодинамики. Мы остановимся на одной из них.
Всё подведённое к системе тепло идёт на изменение внутренней энергии и на совершение системой работы против внешних сил.
Математически этот закон записывается:
Q = DU + L
 2015-04-01
2015-04-01 1325
1325








