- Флавиновые дегидрогеназы. Содержат ФАД. Наиболее обычный субстрат для них - НАДФН2.
- Железо-серный белок. Содержит негеминовое железо с переменной валентностью.
- Цитохром Р450. Его строение отличается от строения цитохромов цепи митоходриального окисления.
Мультиферментный комплекс формирует цепь переноса электронов и протонов, в конце ее происходит активация кислорода. Активированный кислород присоединяется к активному центру цитохрома Р450, и на него переносятся электроны, а затем этот кислород включается в молекулу субстрата.
На первой фазе биотрансформации менее реакционноспособные соединения подвергаются ферментативному гидроксилированию. Такая модификация делает возможной последующую конъюгацию с полярным веществом. Вообще гидроксилирующие ферменты являются монооксигеназами, включающими в качестве кофермента железосодержащий гем. Восстановленная форма гема связывает оксид углерода (СО) и приобретает характерное поглощение света при 450 нм. Поэтому такая группа ферментов носит название цитохромы Р450 (цитР450). Система цитР450 принимает участие во многих процессах обмена веществ, например в биосинтезе стероидных гормонов, желчных кислот и эйкозаноидов,а также в образовании ненасыщенных жирных кислот.
24. Вітаміни. Роль вітамінів у харчуванні тварин і людей. Водорозчинні вітаміни.
Витамины — группа низкомолекулярных органических соединений относительно простого строения и разнообразной химической природы. Это сборная, в химическом отношении, группа органических веществ, объединённая по признаку абсолютной необходимости их для гетеротрофного организма в качестве составной части пищи. Витамины содержатся в пище в очень малых количествах, и поэтому относятся к микронутриентам. Витамины участвуют во множестве биохимических реакций, выполняя каталитическую функцию в составе активных центров большого количества разнообразных ферментов либо выступая информационными регуляторными посредниками, выполняя сигнальные функции экзогенных прогормонов и гормонов. Они не являются для организма поставщиком энергии и не имеют существенного пластического значения. Однако витаминам отводится важнейшая роль в обмене веществ. Концентрация витаминов в тканях и суточная потребность в них невелики, но при недостаточном поступлении витаминов в организм наступают характерные и опасные патологические изменения. Большинство витаминов не синтезируются в организме человека. Поэтому они должны регулярно и в достаточном количестве поступать в организм с пищей или в виде витаминно-минеральных комплексов и пищевых добавок. Исключение составляет витамин К, достаточное количество которого в норме синтезируется в толстом кишечнике человека за счёт деятельности бактерий. С нарушением поступления витаминов в организм связаны 3 принципиальных патологических состояния: недостаток витамина — гиповитаминоз, отсутствие витамина — авитаминоз, и избыток витамина — гипервитаминоз. Известно около полутора десятков витаминов. Исходя из растворимости, витамины делят на жирорастворимые — A, D, E, F, K и водорастворимые — все остальные. Жирорастворимые витамины накапливаются в организме, причём их депо являются жировая ткань и печень. Водорастворимые витамины в существенных количествах не депонируются, а при избытке выводятся. Это с одной стороны объясняет то, что довольно часто встречаются гиповитаминозы водорастворимых витаминов, а с другой — иногда наблюдаются гипервитаминозы жирорастворимых витаминов. Витамины отличаются от других органических пищевых веществ тем, что не включаются в структуру тканей и не используются организмом в качестве источника энергии (не обладают калорийностью).
Поливитамины — фармакологические препараты или естественные многокомпонентные полидисперсные вещества, содержащие в своём составе комплекс витаминов и минеральные соединения. Единственным натуральным пищевым поливитамином является грудное молоко, в котором содержится ценный набор из многих эссенциальных витаминов.
Витамины, которые растворяются в воде и из пищи поступают сразу в кровь, называются водорастворимыми. Они не накапливаются в тканях и достаточно быстро выводятся из организма. С одной стороны, такие свойства позволяют избежать их избытка в организме, с другой – постоянно образующийся дефицит приходится восполнять. Поэтому в ежедневное меню стоит включить продукты, богатые водорастворимыми витаминами.
В группу В входит сразу несколько витаминов. Они принимают активное участие в обмене веществ и регуляции деятельности всего организма.
С (аскорбиновая кислота) повышает иммунитет и ускоряет выздоровление при респираторных заболеваниях, укрепляет кровеносные сосуды, способствует усвоению железа, здоровью десен и костной ткани. Организмом C не вырабатывается, его суточная доза составляет 100 миллиграмм. Обеспечить это количество можно, например, съев полкило свежих апельсинов или грейпфрутов. Много его в помидорах, сладком перце, квашеной капусте, черной смородине, лимонах, киви и бананах. H (биотин) условно относится к группе B. Участвует в обмене веществ, важен для нормального состояния кожи и волос. Питает полезную флору в кишечнике, поддерживает работу нервной системы. Частично вырабатывается в организме. Суточная доза точно не определена, ученые предполагают, что она составляет 200 микрограмм. Столько биотина можно получить из 200 г говяжьей печени. Кроме того, витамин Н содержится в грибах (особенно лисичках), цветной капусте, яблоки, нешлифованном рисе.
Р (биофлавоноиды) – группа биологически активных веществ. Состоит из кверцетина, кахетина, рутина и геспердина и еще почти 5000 других.
РР участвует в обменных процессах организма, регулирует деятельность мозга и работу надпочечников. Суточная доза 15–25 миллиграмм, столько РР содержится в 250 г куриного мяса. Частично он синтезируется микрофлорой в кишечнике человека, а остальное можно получить из печени, почек, говяжьего мяса, зеленых овощей, бобовых и грибов.
N (липоевая кислота) принимает активное участие в обменных процессах в организме, улучшает зрение, усиливает защитные функции печени и регулирует усвоение глюкозы нервными клетками. Усиливает действие других витаминов, например С и Е. Суточная доза 1–2 миллиграмма, столько липоевой кислоты в 200 г молока, или таком же количестве говядины. Также витамин N есть в печени, рисе и капусте.
Поскольку суточная потребность человека в витаминах составляет лиш незначительные их количества (порядка миллиграммов или даже микрограммов), витамины можно назвать микрокомпонентами пищи. В отличие от них макрокомпоненты -углеводы, белки и должны входить в пищевой раціон человека в больших количествах, так как суточная потребность в них исчисляется сотнями или по меньшей мере десятками граммов. Это объясняется тем, что основные пищевые вещества используются в организме в качестве источников энергии и сырья для получения органических предшественников многих клеточных компонентов, а также для того, чтобы обеспечить аминокислотами біосинтез белков. Витамины же, напротив, нужны лишь в малых количествах, потому что они играют роль катализаторов в различных химических превращениях макрокомпонентов пищи - превращениях, которые в совокупности называются обменом веществ, или метаболизмом. Подобно ферментам, витамины присутствуют в тканях в очень низких концентрациях.В настоящее время известно 13 различных витаминов, которые вместе с основными питательными веществами - углеводами, жирами и белками-должны содержаться в пищевом рационе людей и животных многих видов, чтобы обеспечить нормальный рост и жизнедеятельность организма. Термин «витамин» впервые был использован для обозначения специфического микрокомпонента пищи органической природы, предотвращающего обусловленную неполноценным питанием болезнь бери-бери, распространенную когда-то в странах, население которых употребляло в пищу много риса. Поскольку этотмикрокомпонент обладал свойствами амина, Казимир Функ, польский биохимик, первым получивший это вещество в чистом виде, назвал его «витамин», что в переводе означает «необходимый для жизни амин». В дальнейшем, когда были открыты многие другие незаменимые органические микрокомпоненты, оказалось, чго далеко не все они представляют собой амины. Почти все известные витамины присутствуют в клетках всех животных и большинства растений и микроорганизмов, выполняя в них одни и те же важне биохимические функции. Однако не все эти витамины должны обязательно содержаться в пищевом рационе всех видов животных. Например, хотя витамин С должен присутствовать в пище людей, обезьян, морских свинок и индийских крыланов, большинство остальных животных не нуждается в том, чтобы получать его с пищей, так как у них есть ферменты, которые обеспечивают синтез витамина С из такого простого предшественника, как глюкоза. Таким образом, в настоящее время термин витамин применяется в общем смысле для обозначения группы органических веществ, присутствующих в клетках в очень небольших количествах и участвующих в их нормальной жизнедеятельности. При этом некоторые организмы не способны синтезировать те или иные витамины, и потому должны получать их из внешних источников.25. Номенклатура і принципи класифікації ферментів, їхня будова і роль у життєдіяльності організму. Подібність ферментів до небілкових каталізаторів. Активний центр ферменту. Роль металів у ферментативному каталізі.
Согласно Международной классификации, ферменты делят на шесть главных классов, в каждом из которых несколько подклассов: 1) оксидоредуктазы; 2) трансферазы; 3) гидролазы; 4) лиазы; 5) изомеразы; 6) лигазы (синтетазы) (табл. 4.5).
Оксидоредуктазы. К классу оксидоредуктаз относят ферменты, катализирующие с участием двух субстратов окислительно-восстановительные реакции, лежащие в основе биологического окисления. Систематические названия их составляют по форме «донор: акцептор оксидоредуктаза». Например, лактат: НАД+ оксидоредуктаза для лактатдегидрогеназы (ЛДГ). Различают следующие основные оксидоредуктазы: аэробные дегидро-геназы или оксидазы, катализирующие перенос протонов (электронов) непосредственно на кислород; анаэробные дегидрогеназы, ускоряющие перенос протонов (электронов) на промежуточный субстрат, но не на кислород; цитохромы, катализирующие перенос только электронов. К этому классу относят также гемсодержащие ферменты каталазу и пероксидазу, катализирующие реакции с участием перекиси водорода.
Трансферазы. К классу трансфераз относят ферменты, катализирующие реакции межмолекулярного переноса различных атомов, групп атомов и радикалов. Наименование их составляется по форме «донор: транспортируемая группа – трансфераза». Различают трансферазы, катализирующие перенос одноуглеродных остатков, ацильных, гликозильных, альдегидных или кетонных, нуклеотидных остатков, азотистых групп, остатков фосфорной и серной кислот и др. Например: метил- и формилтрансферазы, ацетилтрансферазы, амино-трансферазы, фосфотрансферазы и др.
Гидролазы. В класс гидролаз входит большая группа ферментов, катализирующих расщепление внутримолекулярных связей органических веществ при участии молекулы воды. Наименование их составляют по форме «субстрат-гидролаза». К ним относятся: зстеразы – ферменты, катализирующие реакции гидролиза и синтеза сложных эфиров; гликозидазы, ускоряющие разрыв гликозидных связей; фосфатазы и пептидгидролазы, катализирующие гидролиз фосфоангидридных и пептидных связей; ами-дазы, ускоряющие разрыв амидных связей, отличных от пептидных, и др.
Лиазы. К классу лиаз относят ферменты, катализирующие разрыв связей С—О, С—С, С—N и других, а также обратимые реакции отщепления различных групп от субстратов не гидролитическим путем. Эти реакции сопровождаются образованием двойной связи или присоединением групп к месту разрыва двойной связи. Ферменты обозначают термином «субстрат-лиазы». Например, фумарат-гидратаза (систематическое название «L-малат-гидролаза») катализирует обратимое отщепление молекулы воды от яблочной кислоты с образованием фумаровой кислоты. В эту же группу входят декарбоксилазы (карбокси-лиазы), амидин-лиазы и др.
Изомеразы. К классу изомераз относят ферменты, катализирующие взаимопревращения оптических и геометрических изомеров. Систематическое название их составляют с учетом типа реакции: «субстрат – цис-транс-изомераза». Если изомеризация включает внутримолекулярный перенос группы, фермент получает название «мутаза». К этому же классу относят рацемазы и эпимеразы, действующие на амино- и оксикислоты, углеводы и их производные; внутримолекулярные оксидоредуктазы, катализирующие взаимопревращения альдоз и кетоз; внутримолекулярные трансферазы, переносящие ацильные, фосфорильные и другие группы, и т.д.
Лигазы(синтетазы). К классу лигаз относят ферменты, катализирующие синтез органических веществ из двух исходных молекул с использованием энергии распада АТФ (или другого нуклеозидтрифосфата). Систематическое название их составляют по форме «X: Y лигаза», где X и Y обозначают исходные вещества. В качестве примера можно назвать L-глутамат: аммиак лигазу (рекомендуемое сокращенное название «глутаминсинтета-за»), при участии которой из глутаминовой кислоты и аммиака в присутствии АТФ синтезируется глутамин.
Субстратом (S) называют вещество, химические превращения которого в продукт (Р) катализирует фермент (Е). Тот участок поверхности молекулы фермента, который непосредственно взаимодействует с молекулой субстрата, называется активным центром фермента.
Активный центр фермента образован из остатков аминокислот, находящихся в составе различных участков полипептидной цепи или различных полипептидных цепей, пространственно сближенных. Образуется на уровне третичной структуры белка-фермента.
Активный центр — особая часть молекулы фермента, определяющая её специфичность и каталитическую активность. Активный центр непосредственно осуществляет взаимодействие с молекулой субстрата или с теми её частями, которые непосредственно участвуют в реакции. Характер взаимодействия фермента и субстрата говорит о наличии в активном центре ряда структурных групп, соединяющихся с различными участками субстрата. Взаимодействие между активным центром фермента и молекулой субстрата осуществляется при их сближении на расстояние порядка 15—20 ангстрем, с увеличением расстояния оно быстро ослабевает (хотя среди различных ферментов могут иметь место вариации).
В его пределах различают Адсорбционный участок (центр) и каталитический участок (центр).
Каталитический центр - это та область (зона) активного центра фермента, которая непосредственно участвует в химических преобразованиях субстрата. Формируется он за счет радикалов двух, иногда трех аминокислот, расположенных в разных местах полипептидной цепи фермента, но пространственно сближенных между собой за счет изгибов этой цепи. Например, каталитический центр "серин-гистидиновых" ферментов формируется за счет радикалов аминокислот серина и гистидина. Если фермент является сложным белком, то в формировании каталитического центра нередко участвует простетическая группа молекулы фермента (кофермент). Коферментную функцию выполняют все водорастворимые витамины и жирорастворимый витамин K.
Адсорбционный центр - это участок активного центра молекулы фермента, на котором происходит сорбция (связывание) молекулы субстрата. Он формируется одним, двумя, чаще тремя радикалами аминокислот, которые обычно расположены рядом с каталитическим центром. Главная его функция - связывание молекулы субстрата и передача этой молекулы каталитическому центру в наиболее удобном положении (для каталитического центра). Эта сорбция происходит только за счет слабых типов связей и потому является обратимой. По мере формирования этих связей происходит конформационная перестройка адсорбционного центра, которая приводит к более тесному сближению субстрата и активного центра фермента, более точному соответствию между их пространственными конфигурациями. Такое соответствие - не заранее "готовое", а формирующееся в ходе взаимодействия - американский ученый Кошленд положил в основу теории индуцированного соответствия (или наведенного соответствия), которая преодолела ограниченность существовавшей ранее теории ключа и замка (жесткого соответствия структуры субстрата структуре адсорбционного центра).
В человеческом организме беспрерывно работают тысячи различных ферментов — белковых энзимов, выполняющих функцию специфических катализаторов превращения веществ в организме. Только с их помощью возможно обновление состарившихся и изношенных клеток, превращение питательных веществ в энергию жизни и строительные материалы для создания новых клеток, обезвреживание отходов (продуктовобмена веществ, или метаболизма, чужеродных телу веществ), защита организма от болезнетворных микроорганизмов и даже заживление ран.
Энзимы — это крошечные, невидимые нашему глазу «биохимики». Благодаря наличию энзимов (ферментов) в живом организме осуществляются, ускоряются, управляются все жизнеобеспечивающие процессы. Сами энзимы при этом не изменяются. Вот почему их называют биокатализаторами.
Сходство ферментов с небиологическими катализаторами заключается в том, что:
- ферменты катализируют энергетически возможные реакции;
- энергия химической системы остаётся постоянной;
- в ходе катализа направление реакции не изменяется;
- ферменты не расходуются в процессе реакции.
Отличия ферментов от небиологических катализаторов заключаются в том, что:
- скорость ферментативных реакций выше, чем реакций, катализируемых небелковыми катализаторами;
- ферменты обладают высокой специфичностью;
- ферментативная реакция проходит в клетке, т.е. при температуре 37 °С, постоянном атмосферном давлении и физиологическом значении рН;
- скорость ферментативной реакции может регулироваться.
Ферментативный катализ (биокатализ), ускорение биохим. р-ций при участии белковых макромолекул, называемых ферментами(энзимами). Ферментативный катализ- разновидность катализа, хотя термин "ферментация" (брожение)известен с давних времен, когда еще не было понятия хим. катализа.
26. Вуглеводи та їхня біологічна роль. Класифікація та номенклатура вуглеводів. Структура і властивості моно- і полісахаридів.
Углеводы (сахара) — группа природных полигидроксиальдегидов и полигидроксикетонов с общей формулой (CH2O)n. Группа включает простые сахара (моносахариды) и их высокомолекулярные аналоги, олигосахариды и полисахариды. Полисахариды, прежде всего крахмал и некоторые дисахариды, являются важными (хотя и не жизненно необходимыми) компонентами питания. В кишечнике они расщепляются до моносахаридов, которые затем всасываются слизистой кишечника. Транспортной формой углеводов в крови позвоночных является глюкоза. Глюкоза поступает в клетки, где используется в качестве клеточного "топлива" (гликолиз) или превращается в другие метаболиты. Гликоген откладывается в некоторых органах (печень, мышцы) в качестве резервного полисахарида Полисахариды служат строительным материалом для многих организмов. Так, в клеточных стенках бактерий в качестве стабилизирующего структурного компонента присутствует муреин В растениях эту функцию выполняют целлюлоза и другие полисахариды.Олигомерные и полимерные углеводы часто встречаются в ковалентно связанном виде с липидами (гликолипиды) или белками (гликопротеины), входящими в состав клеточных мембран. Растворимые гликопротеины присутствуют в плазме крови, а также входят в состав протеогликанов, которые являются важными структурными компонентами межклеточного матрикса.
Структура моносахаридів. Важнейший природный моносахарид, D- глюкоза, является алифатическим альдегидом, содержащим шесть углеродных атомов, пять из которых имеют гидроксильные группы. Поскольку атомы С-2 — С-5 являются хиральными центрами кроме D-глюкозы существует 15 изомерных альдогексоз, лишь немногие из которых встречаются в природе. У большинства природных моносахаридов С-5 имеет конфигурацию D-глицеринового альдегида. В нейтральном растворе менее 0,1% молекул глюкозы находятся в ациклической форме, Подавляющая часть глюкозы присутствует в форме циклического полуацеталя, образованного в результате взаимодействия карбонильной группы с одной из гидроксильных групп. В альдогексозах реакция идет главным образом по гидроксильной группе С-5 с образованием шестичленного пиранового цикла. Сахара с шестичленным циклом называются пиранозами. Замыкание кольца с участием гидроксильной группы С-4 дает фурановый цикл, а сахара с таким циклом называются фуранозами. В растворе все три формы, пиранозная, фуранозная и ациклическая находятся в динамическом равновесии. Циклические формы моносахаридов принято изображать в виде проекционных формул, где цикл представлен в перспективе (проекции Хеуорса) Заместители при хиральных атомах углерода располагаются над или под плоскостью кольца в зависимости от их конфигурации. ОН-Группы, которые в фишеровской проекции находятся справа, в проекции Хеуорса располагаются под плоскостью кольца, а группы, находящиеся слева, — над плоскостью кольца. При образовании полуацеталей в молекуле появляется дополнительный асимметрический центр С-1, что делает возможным существование двух стерео изомеров. Соответствующие связи на схеме указаны волнистыми линиями. В проекциях Хеуорса не учитывается тот факт, что в действительности пиранозный цикл не плоский, а имеет форму кресла. В представленной на схеме конформации D-глюкопиранозы (1С4-конформация, 3) большинство OH-гpyпп (как и в проекции Хеуорса) располагаются перпендикулярно плоскости кольца (аксиально, а-положение). Единственное исключение составляет полуацетальная ОН-группа при С-1, которая занимает экваториальное (е) положение.
Структура полисахаридов. Полисахариды, построенные из моносахаридных звеньев одного типа, называются гомогликаны, а построенные из различных моносахаридных звеньев — гетерогликаны. Оба полимера могут быть линейными или разветвленными.
В качестве примера разветвленного гомогликана здесь представлен фрагмент молекулы гликогена. Похожее строение имеет амилопектин, разветвленный компонент растительного крахмала. Оба полимера построены в основном из остатков глюкозы, связанных в положении α(1→4). B гликогене точки ветвления располагаются в среднем через каждые 8-10 остатков глюкозы. Связи в точках ветвления находятся в положении α(1→8), остальные остатки боковой цепи связаны в положении α(1→4). За счет этого образуется разветвленная, древовидная структура, в которой имеется только одна аномерная ОН-группа, т.е. только один восстанавливающий конец. Сложную структуру имеет линейный гетерогликан муреин, который в качестве структурного полисахарида придает прочность клеточным стенкам бактерий. На схеме приведен только один сегмент этой нитевидной молекулы. В муреине чередуются остатки двух различных моносахаридов, связанных в положении β(1→4): N- ацетилглюкозамина (GlcNAc) и характерной для муреина N- ацетилмурамовой кислоты (MurNAc). Последняя является простым эфиром молочной кислоты с N-ацетилглюкозамином. В клеточной стенке карбоксильная группа молочной кислоты связана амидной связью с пептидом (на схеме показан условно), который соединяет отдельные цепи муреина в трехмерную сетчатую структуру (на схеме не приведена).
По функциональным свойствам они подразделяются на три группы. Структурные полисахариды придают клеткам, oрганам и целым организмам механическую прочность. Водорастворимые полисахариды высоко гидратированы и предохраняют от высыхания клетки и ткани. Наконец, резервные полисахариды служат энергетическим ресурсом, из которого номере необходимости в организм поступают моносахариды, являющиеся клеточным "топливом". Благодаря полимерной природе резервные полисахариды осмотически неактивны и поэтому могут накапливаться в клетках в больших количествах.
Углеводы служат основным источником энергии. Свыше 56% энергии организм получает за счет углеводов, остальную часть - за счет белков и жиров. В зависимости от сложности строения, растворимости, быстроты усвоения углеводы пищевых продуктов подразделяются на простые углеводы: моносахариды (глюкоза, фруктоза, галактоза), дисахариды (сахароза, лактоза) и сложные углеводы, или полисахариды (крахмал, гликоген, клетчатка). Простые углеводы легко растворяются в воде и быстро усваиваются. Они обладают выраженным сладким вкусом и относятся к сахарам. Наиболее распространенный моносахарид - глюкоза - содержится во многих плодах и ягодах, а также образуется в организме в результате расщепления дисахаридов и крахмала пищи. Глюкоза наиболее быстро и легко используется в организме для образования гликогена, для питания тканей мозга, работающих мышц (в том числе и сердечной мышцы), для поддержания необходимого уровня сахара в крови и создания запасов гликогена печени. Во всех случаях при большом физическом напряжении глюкоза может использоваться как источник энергии. Фруктоза обладает теми же свойствами, что и глюкоза, и может рассматриваться как ценный, легкоусвояемый сахар. Однако она медленнее усваивается в кишечнике и, поступая в кровь, быстро покидает кровяное русло. Фруктоза в значительном количестве (до 70 - 80%) задерживается в печени и не вызывает перенасыщение крови сахаром. В печени фруктоза более легко превращается в гликоген по сравнению с глюкозой. Фруктоза усваивается лучше сахарозы и отличается большей сладостью. Высокая сладость фруктозы позволяет использовать меньшие ее количества для достижения необходимого уровня сладости продуктов и таким образом снизить общее потребление сахаров, что имеет значение при построении пищевых рационов ограниченной калорийности. Избыток сахарозы оказывает влияние на жировой обмен, усиливая жирообразование. Установлено, что при избыточном поступлении сахара усиливается превращение в жир всех пищевых веществ (крахмала, жира, пищи, частично и белка). Таким образом, количество поступающего сахара может служить в известной степени фактором, регулирующим жировой обмен. Обильное потребление сахара приводит к нарушению обмена холестерина и повышению его уровня в сыворотке крови. Избыток сахара отрицательно сказывается на функции кишечной микрофлоры. При этом повышается удельный вес гнилостных микроорганизмов, усиливается интенсивность гнилостных процессов в кишечнике, развивается метеоризм. Установлено, что в наименьшей степени эти недостатки проявляются при потреблении фруктозы. Основными источниками фруктозы являются фрукты и ягоды. Глюкоза и фруктоза широко представлены в меде: содержание глюкозы достигает 36.2%, фруктозы - 37.1%. В арбузах весь сахар представлен фруктозой, количество которой составляет 8%. Третий моносахарид - галактоза - в свободном виде в пищевых продуктах не встречается. Галактоза является продуктом расщепления основного углевода молока - лактозы. Из дисахаридов в питании человека основное значение имеет сахароза, которая при гидролизе распадается на глюкозу и фруктозу. Источниками сахарозы в питании человека являются, главным образом, тростниковый и свекловичный сахар. Содержание сахарозы в сахаре-песке составляет 99.75%. Натуральными источниками сахарозы являются бахчевые, некоторые овощи и фрукты.
27. Сучасні уявлення про структуру білків. Рівні просторової організації білка. Характеристика зв`язків, які їх стабілізують. Шаперони та їхня біологічна роль.
При соединении аминокислот в цепочку образуется линейная макромолекула белка. В любом живом организме содержатся тысячи белков, выполняющих разнообразные функции.
Кроме последовательности аминокислот полипептида (первичной структуры), крайне важна третичная структура белка, которая формируется в процессе фолдинга (от англ. folding, «сворачивание»). Третичная структура формируется в результате взаимодействия структур более низких уровней. Выделяют четыре уровня структуры белка[14]:
- Первичная структура — последовательность аминокислот в полипептидной цепи. Важными особенностями первичной структуры являются консервативные мотивы — сочетания аминокислот, играющих ключевую роль в функциях белка. Консервативные мотивы сохраняются в процессе эволюции видов, по ним часто удаётся предсказать функцию неизвестного белка.
- Вторичная структура — локальное упорядочивание фрагмента полипептидной цепи, стабилизированное водородными связями. Ниже приведены самые распространённые типы вторичной структуры белков:
- α-спирали — плотные витки вокруг длинной оси молекулы, один виток составляют 3,6 аминокислотных остатка, и шаг спирали составляет 0,54 нм[15] (так что на один аминокислотный остаток приходится 0,15 нм), спираль стабилизирована водородными связями между H и O пептидных групп, отстоящих друг от друга на 4 звена. Спираль построена исключительно из одного типа стереоизомеров аминокислот (L). Хотя она может быть как левозакрученной, так и правозакрученной, в белках преобладает правозакрученная. Спираль нарушают электростатические взаимодействия глутаминовой кислоты, лизина, аргинина. Расположенные близко друг к другу остатки аспарагина, серина, треонина и лейцина могут стерически мешать образованию спирали, остатки пролина вызывает изгиб цепи и также нарушает α-спирали.
- β-листы (складчатые слои) — несколько зигзагообразных полипептидных цепей, в которых водородные связи образуются между относительно удалёнными друг от друга (0,347 нм на аминокислотный остаток[15]) в первичной структуре аминокислотами или разными цепями белка, а не близко расположенными, как имеет место в α-спирали. Эти цепи обычно направлены N-концами в противоположные стороны (антипараллельная ориентация). Для образования β-листов важны небольшие размеры боковых групп аминокислот, преобладают обычно глицин и аланин.
- π-спирали;
- 310-спирали;
- неупорядоченные фрагменты.
- Третичная структура — пространственное строение полипептидной цепи (набор пространственных координат составляющих белок атомов). Структурно состоит из элементов вторичной структуры, стабилизированных различными типами взаимодействий, в которых гидрофобные взаимодействия играют важнейшую роль. В стабилизации третичной структуры принимают участие:
- ковалентные связи (между двумя остатками цистеина — дисульфидные мостики);
- ионные связи между противоположно заряженными боковыми группами аминокислотных остатков;
- водородные связи;
- гидрофильно-гидрофобные взаимодействия. При взаимодействии с окружающими молекулами воды белковая молекула «стремится» свернуться так, чтобы неполярные боковые группы аминокислот оказались изолированы от водного раствора; на поверхности молекулы оказываются полярные гидрофильные боковые группы.
- Четверичная структура (или субъединичная, доменная) — взаимное расположение нескольких полипептидных цепей в составе единого белкового комплекса. Белковые молекулы, входящие в состав белка с четвертичной структурой, образуются на рибосомах по отдельности и лишь после окончания синтеза образуют общую надмолекулярную структуру. В состав белка с четвертичной структурой могут входить как идентичные, так и различающиеся полипептидные цепочки. В стабилизации четвертичной структуры принимают участие те же типы взаимодействий, что и в стабилизации третичной. Надмолекулярные белковые комплексы могут состоять из десятков молекул.
К настоящему времени описано несколько классов шаперонов, различающихся по структуре и специфическим функциям. Все шапероны являются так называемыми "белками теплового шока", синтез которых резко увеличивается в стрессовых для клетки ситуациях. Поэтому сокращенное название этих белков - hsp (heat shock proteins). Однако и в нормальных условиях каждая клетка содержит определенный набор шаперонов, необходимых для ее жизнедеятельности. Классификация шаперонов основана на величине молекулярной массы составляющих их полипептидных цепей (субъединиц), которая варьирует от 10 кДа (килодальтонов) (для белка hsp10) до 90 кДа (для белка hsp90) и выше. По характеру выполняемых этими белками функций их можно разделить на два больших семейства - шапероны, или hsp70, и шаперонины, к которым относятся hsp60 и hsp10.
Шапероны, удерживающие белки в развернутом состоянии
Взаимодействие шаперонов с синтезируемым белком начинается еще до схождения полипептидной цепи с рибосомы. Связываясь с отдельными участками "опекаемой" ими полипептидной цепи, молекулы hsp70 образуют прочные комплексы, удерживающие цепь в развернутом состоянии. Взаимодействие не является специфическим (шапероны не различают белки по их аминокислотной последовательности) и в основном реализуется благодаря силам гидрофобного характера. Прочно фиксированная на шаперонах полипептидная цепь не способна к сворачиванию в нативную структуру, так как не обладает необходимой для этого подвижностью. Главная функция hsp70 состоит в удержании вновь синтезируемых белков от неспецифической агрегации и в их передаче другому "белку-помощнику", шаперонину, роль которого - обеспечить оптимальные условия для эффективного сворачивания.
В клетках эукариот шапероны выполняют также важную роль в транспорте белков через мембраны митохондрий, хлоропластов и эндоплазматического ретикулума. Такой транспорт необходим, так как многие белки клеточных органелл синтезируются в цитоплазме, а окончательно сворачиваются в месте своей постоянной локализации. Роль hsp70, "подносящего" к мембране частично развернутый белок, становится понятной, если учесть, что разворачивание - обязательное условие проникновения белковой молекулы через мембрану. Интересно, что митохондриальный матрикс содержит собственные шапероны, "подхватывающие" пересекающий мембрану белок и способствующие его "втягиванию" в митохондрию. Аналогичный механизм реализуется и при проникновении синтезированных в цитоплазме белков в просвет эндоплазматического ретикулума. Возникает вопрос: от чего же зависит прочность связывания шаперона с полипептидной цепью? Каков механизм, позволяющий развернутому белку освободиться от hsp70 и перейти на шаперонин (hsp60)? Детальные исследования, проведенные на системах белков, выделенных из клеток бактерий, показали, что главным фактором является способность шаперона связывать АТФ, в определенных условиях осуществлять его гидролиз и изменять прочность взаимодействия с полипептидной цепью в зависимости от природы связанного нуклеотида (АТФ или АДФ). Согласно предложенной схеме (которая, вероятно, применима и для описания действия шаперонов в цитоплазме эукариотической клетки, а также в матриксе митохондрий), происходит следующее:Шаперон, содержащий связанную АТФ, присоединяет (в присутствии специального "белка-помощника") развернутую полипептидную цепь. Это сопровождается гидролизом АТФ и образованием прочного комплекса шаперона (в связи с АДФ), полипептидной цепи и "белка-помощника".
Создав шаперонины, природа нашла элегантный способ обеспечить сворачивание белка в условиях, исключающих его агрегацию с другими белками внутри клетки. Действительно, попадая в центральный канал молекулы шаперонина, единичная полипептидная цепь оказывается полностью изолированной и получает возможность реализовывать медленные стадии сворачивания с очень высоким выходом нативного белка. Как и в случае hsp70, связывание развернутого белка с шаперонином и его отщепление регулируются АТФ-азной активностью шаперонина. В связывании сворачивающегося белка (находящегося в состоянии "расплавленной глобулы") может принимать участие каждая из 14 субъединиц олигомерной молекулы шаперонина. Количество мест связывания зависит от стадии сворачивания: чем ближе структура к нативной, тем меньше участков, "распознаваемых" шаперонином. Роль маленького шаперонина hsp10, называемого ко-шаперонином, закрывающего вход в центральный канал, состоит в том, чтобы предотвращать "преждевременный" выход во внешнюю среду белка, не завершившего окончательное сворачивание в нативную структуру.
28. Коферменти і вітаміни. Роль металів та інших кофакторів у функціонуванні ферментів.
Коферменты (синоним коэнзимы) — органические соединения небелковой природы, необходимые для осуществления каталитического действия многих ферментов. Соединяясь с белковой частью молекулы фермента — апоферментом, К. образуют каталитически активный комплекс — холофермент. Прочно связанные с белками К. называются простетическими группами. Многие К. легко отделяются от ферментного белка и служат переносчиками электронов, отдельных атомов или групп атомов субстрата, превращение которого катализирует данный фермент, т.е. функционируют в качестве промежуточных акцепторов. К. могут участвовать в активировании молекул субстратов, образуя с ними реакционно-способные соединения, которые затем подвергаются ферментативному превращению. Некоторые метаболиты, выступающие в ферментативных реакциях как обычные субстраты, в определенных условиях могут выполнять роль К. Многие К. являются производными витаминов, поэтому нарушение обмена веществ при витаминной недостаточности опосредовано через понижение активности определенных ферментов.
Коферменты, как правило, термостабильны, разнообразны по химическому строению и механизму действия. Наиболее распространенную группу составляют соединения нуклеотидной природы, а также К., содержащие остатки фосфорной кислоты. Адениловые нуклеотиды наряду с их ключевой ролью в обмене энергии (см. Макроэргические соединения, Обмен веществ и энергии) в качестве К. участвуют в реакциях переноса и активации орто- и пирофосфатных остатков, аминоацильных групп, остатков неорганических кислот. В группу адениловых нуклеотидов входят аденозинфосфорные кислоты — нуклеотиды, содержащие аденин, рибозу и остатки фосфорной кислоты (АДФ и АМФ). В подобных реакциях могут участвовать в качестве К. также производные инозин-5'-фосфорной и гуанозин-5'-фосфорной кислот. Гуаниловые рибонуклеотиды (гуанозин-5'-моно-, ди- и трифосфорные кислоты) выполняют роль К. в реакциях переноса сукцинильной группы, при биосинтезе рибонуклеопротеинов в микросомах, биосинтезе адениловой кислоты из инозиновой кислоты и др. Цитидиловые рибонуклеотиды (цитидил-5'-моно-, ди- и трифосфорные кислоты) играют роль К. при биосинтезе фосфолипидов, участвуя в переносе остатков, образующих полярные «головки» молекул фосфолипидов (0-фосфоэтанолхолина, 0-фосфоэтаноламина и др.). Уридиловые рибонуклеотиды (уридин-5'-моно, ди- и трифосфорные кислоты) участвуют в качестве К. в процессах трансгликозилирования (переноса остатков простых сахаров и их производных) при биосинтезе ди- и полисахаридов, гликозаминогликанов и реакциях взаимопревращения сахаров.
К важнейшим К. нуклеотидной природы относятся никотинамидные К. никотинамидадениндинуклеотид (НАД, NAD+; синоним: дифосфопиридиннуклеотид, ДПН; устаревшее кофермент I, Kol, козимаза, кодегидр (оген)аза I] и его фосфорилированное производное никотинамидадениндинуклеотидфосфат [НАДФ, NADP+; синоним: трифосфопиридиннуклеотид, ТПН; устаревшее кофермент II, KoII, фосфокозимаза, фосфокодегидр(оген)аза]. Никотинамидные К. входят в состав ряда дегидрогеназ — катализаторов ключевых окислительно-восстановительных реакций энергетического и пластического обмена. Молекула НАД представляет собой динуклеотид, построенный из аденинрибонуклеотида и никотинамидрибонуклеотида (последний отвечает за проявление каталитической активности НАД), связанных фосфоангидридным мостиком, а НАДФ имеет третий остаток фосфорной кислоты в положении 2' рибозы аденилового нуклеотида. Способность НАД и НАДФ переносить электроны и протоны от окисляемого субстрата к другому акцептору обеспечивает выполнение этими К. важной биологической функции в процессе клеточного дыхания (см. Дыхание тканевое). Окислительно-восстановительные реакции, протекающие с участием никотинамидных К., могут быть изображены в виде общего уравнения; АН2 + НАД(Ф)+ = А + НАД(Ф)Н + Н+, где АН2 восстановленная форма субстрата. А — окисленная форме субстрата. Эти реакции состоят в обратимом переносе двух восстановительных эквивалента от субстрата к окисленному никотинамидному К. Один восстановительный эквивалент присутствует в восстановленном К. в виде атома водорода, другой — в виде электроне, при этом катион второго атома водорода переходит в среду а виде свободного Н+. Обнаружено около 350 НАД(Ф)-зависимых дегидрогеназ, как правило, специфичных в отношении либо НАД, либо НАДФ. Обычно связь никотинамидных и других нуклеотидных К. с белками легко диссоциирует. НАД-зависимые дегидрогеназы участвуют преимущественно в процессах катаболизма (например, в клеточном дыхании), в НАДФ-зависимые — главным образом в анаболических процессах (восстановительных биосинтетических реакциях). Содержание никотинамидных К., соотношение между их окисленными и восстановленными формами (НАДН и НАДФН), к также величию отношения НАД/НАДФ являются показателями активности метаболических процессов в ткани, характеризуют ее функциональное состояние. В организме НАД и НАДФ синтезируются из никотиновой кислоты (ниацина, или витамина РР) или никотинамида, поэтому недостаточность ниацина ведет к нарушению биосинтеза никотинамидных коферментов.
Определение этих К. производят обычно спектрофотометрически (по характерному поглощению окисленных форм при 260 нм восстановленных форм или при 340 нм), флюориметрически (длина волны возбуждения 340 нм, флюоресценции 480 нм) или потенциометрически.
Флавиновые нуклеотиды, или флавиновые К. (флавинмононуклеотид, ФМН, 5-фосфорный эфир рибофлавина.; флавинадениндинуклеотид, ФАД, рибофлавин-5'-аденозиндифосфат), являются К. так называемых флавопротеинов — ферментов, широко распространенных в живых клетках, принимающих участие в обмене основных классов органических соединений и играющих важную роль в процессе биологического окисления (см. Дыхание тканевое). К флавиновым К. относится рибофлавин (витамин В2), недостаточность которого приводит к нарушению нормального функционирования флавинзависимых ферментов. В окисленном состоянии флавиновые К. имеют интенсивный желтый цвет, в восстановленном состоянии они бесцветны. Как правило, ФМН и ФАД прочно связаны с соответствующими белками-апоферментами. Флавопротеины (ферменты, коферментами которых являются производные флавинов) принадлежат к дыхательным ферментам класса оксидоредуктаз. Механизм окислительно-восстановительных реакций, катализируемых ими, обусловлен последовательным окислением и восстановлением флавиновых коферментов. Ряд ферментов (например, монооксигеназы) наряду с флавиновыми используют и никотинамидные К. Определение флавиновых К. проводят спектрофотометрически или флюориметрически в характерных для них областях поглощения при определенных длинах волн.
Кофермент А (КоА, восстановленная форма KoASH; синоним коэнзим А) — соединение аденозин-3',5'-фосфорной кислоты и -меркаптоэтиламида пантотеновой кислоты, образующее с остатками органических кислот (R) тиоэфиры типа R—СО—SKoA. Играет роль К. в переносе и активировании кислотных остатков в реакциях ацилирования, конденсации, оксидоредукции или гидратации органических кислот. КоА участвует в клеточном дыхании, биосинтезе и окислении жирных кислот, синтезе стероидов. Для нормального синтеза КоА необходимо адекватное поступление в организм пантотеновой кислоты, входящей в состав КоА.
Кофермент В12 (КоВ12, витамин В12) — -(5,6-диметилбензимидазолил)-кобаламинцианид является коферментом ферментов, участвующих в переносе одноуглеродных фрагментах, обмене метионина и других соединений. Недостаток в рационе витамина В12, вызывающий в организме дефицит кофермента В12, клинически проявляется мегалобластной гиперхромной анемией, ее так называемой нутритивной (алиментарной) В12-дефицитной формой. Эндогенная недостаточность витамина В12 вследствие нарушения всасывания этого витамина в кишечнике также приводит к дефициту кофермента В12, клинически проявляющемуся одной из форм мегалобластной гиперхромной анемии — пернициозной (В12-дефицитной) анемией, или анемией Аддисона — Бирмера.
Пиридоксальфосфат и его производные являются простетическими группами ряда ферментов, участвующих в обмене аминокислот (реакциях трансаминирования, декарбоксилирования и др.), а также фермента гликогенфосфорилазы. При недостаточном поступлении в организм пиридоксальфосфата — производного витамина В6 — нарушаются функции пиридоксальзависимых ферментов.
Дифосфотиамин является коферментом кетолаз и транскетолаз — ферментов, участвующих в декарбоксилировании -кетокислот и расщеплении углеродной цепи фосфорилированных сахаров, и представляет собой производное витамина В1 (тиамина).
Менее распространены К. пептидной природы, важнейшим представителем которых является глутатион (CSH, ГSH, окисленный глутатион — CSSC или ГSSГ) — -L-глутамил-L-цистеинил-L-глицин, который принимает активное участие во многих окислительно-восстановительных реакциях и обеспечивает функционирование ряда SH-зависимых ферментов. Наиболее важной функциональной группой восстановленной формы глутатиона является сульфгидрильная (SH-) группа, которая легко подвергается ферментативному или неферментативному окислению с образованием дисульфидной (окисленной) формы глутатиона, состоящей из двух молекул восстановленного глутатиона (Г—S— S—Г). Таким образом глутатион функционирует как переносчик водорода. Глутатион принимает прямое участие в некоторых реакциях цис-транс-изомеризации, является коферментом системы глиоксилазы, формальдегид-дегидрогеназы, глутатионпероксидазы. С генетически обусловленным нарушением обмена глутатиона связан ряд наследственных болезней, в т.ч. наследственные гемолитические анемии. Определение глутатиона производят колориметрически и ферментативными методами с применением глутатионпероксидазы и глутатионредуктазы.
Липоевая (тиоктовая) кислота — насыщенная серосодержащая жирная кислота — входит в качестве одного из К. в состав мультиферментных комплексов, осуществляющих декарбоксилирование -кетокислот (пировиноградной, -кетоглутаровой кислот). Выполняет роль промежуточного акцептора водорода и кислотных остатков за счет своей способности к обратимому восстановлению (переход S—SSH).
Витамины К — жирорастворимые соединения, производные нафтохинона — играют роль К. в реакциях системы свертывания крови. Их водорастворимый аналог — викасол — применяют в медицине в качестве лекарственного средства.
Биотин (витамин Н) — водорастворимый витамин — выступает в качестве К. (простетической группы) в составе ряда ферментов, катализирующих реакции карбоксилирования — декарбоксилирования некоторых органических кислот, например пируваткарбоксилазы и ацетил-КоА-карбоксилазы — ферментов начальных этапов глюконеогенеза и синтеза липидов соответственно. В активном центре молекулы карбоксилаз биотин прочно связан амидной связью с -аминогруппой остатка лизина фермента.
О биохимической функции некоторых витаминов впервые стало известно в 30-е годы благодаря слиянию двух направлений исследований, одно из которых имело целью изучение химической структуры коферментов, а другое-изучение строения витаминов. В 1935 г. неметкому биохимику Отто Варбургу удалось выделить и установить структуру кофермента (сейчас его называют ниндинуклеотидфосфатом), необходимого для катализа определенных окислительно-восстановительных реакций в клетке. Варбург показал, что один из компонентов этого кофермента представляет собой простое органическое соединение-никотинамид, которое задолг о до того было впервые выделено из табака. Несколько позже американские биохимики Д. Уайн Улли и Конрад Элведжем попитались установить химическое строение выделенного ими из мяса и других пищевых продуктов вещества, которое предотвращало или излечивало обусловленное неполноценным питанием заболевание собак «черный язык», аналогичное пеллагре человека. Улли и Элведжем были поражены тем, что по некоторым химическим свойствам выделенное ими вещество напоминало никотинамид. Поэтому они попробовали лечить собак чистым амидом, и такое лечение оказалось успешным. В скором времени было установлено, что никотинамидом можно излечивать также и пеллагру у людей. Теперь мы знаем, что никотинамид-это компонент кофермента, необходимого для ферментативного катализа ряда жизненно важных окислительных реакций. Несмотря на очень простое строение молекулы никотинамида, большинство животных не может синтезировать его в достаточных количествах и потому должно получать его с пищей. Вскоре после этого выяснилось, что другие витамины также функционируют в качестве компонентов коферментов и простетических групп ферментов. Содержание витаминов в пище может бать крайне незначительным, поскольку ферменты, выполняющие функции катализаторов, необходимы клеткам в очень низких концентрациях. Например, минимальное количество витамина В6, которое должно содержаться в суточном рационе человека, составляет около 2 мг, а витамина В, 2-менее 3 мкг. Примерно в то же время было обнаружено, что в пище животных, кроме витаминов, должен присутствовать целый ряд неорганических элементов, которые так же, как и коферменты, необходимы для активности определенных ферментов. В качестве примера можно привести цинк - незаменимый элемент питания человека и животных, являющийся важным компонентом множества различных ферментов. В этой главе мы в общих чертах рассмотрим функции различных витаминов как коферментов. В последующих главах мы узнаем, почему не достаток витаминов, а следовательно, и нарушение действия ферментов могут приводить к серьезным изменениям ключевых путейметаболизма углеводов, жиров и белков.
29. Гормони: загальна характеристика, роль у міжклітинній інтеграції функцій організму. Класифікація гормонів.
Гормоны — сигнальные вещества, образующиеся а клетках эндокринных желез. После синтеза гормоны поступают в кровь и переносятся к органам-мишеням, где выполняют определенные биохимические и физиологические регуляторные функции. Границы между гормонами и другими сигнальными веществами, такими, как медиаторы, нейромедиаторы и ростовые факторы довольно условные. Часто эти сигнальные вещества имеют общие закономерности биосинтеза, метаболизма и механизма действия.
Существуют три класса гормонов: пептидные, стероидные и амины. К числу пептидных гормонов, которые могут содержать от 3 до 200 аминокислотных остатков, относятся все гормоны гипоталамуса и гипофиза, а также инсулин и глюкагон, секретируемые поджелудочной железой. Гормоны, принадлежащие к классу аминов, представляют собой низкомолекулярные водорастворимые соединения, содержащие в своем составе аминогруппы, к их числу относятся адреналин, секретируемый мозговым слоем надпочечников, и тиреоидные гормоны. К стероидным гормонам (которые хорошо растворимые в жирах) относятсягормоны коры надпочечников, андрогены (мужские половые гормоны) и эстрогены (женские половые гормоны). Из всех гормонов наиболее полно изучен адреналин. Его хорошо известный механизм действия используется в качестве модели при исследовании других гормонов. Органы мишени адреналина – печень и скелетные мышци, а также сердце и сердечно – сосудистая система. Адреналин и норадреналин очень близкие по структуре гормоны. Они образуются в мозговом слое надпочечнков, расположенных непосредственно над почками.
Гормоны щитовидной железы представляют два различных класса гормонов, выполняющих разные физиологические функции. Щитовидная железа производит два так называемых тиреоидных гормона:
•тироксин
•трийодтиронин,
Они являются йодированными производными аминокислоты тирозина и отличаются лишь числом атомов йода в молекуле, но имеют общие физиологические свойства.
Кроме того, щитовидная железа производит также пептидный гормон
•тиреокальцитонин (кальцитонин), который принимает участие в регуляции фосфорно-кальциевого обмена, активности остеокластов и остеобластов.
Гормоны щитовидной железы обладают специфической чертой. Для их биологической активности требуется микроэлемент йод, который в малых количествах присутствует в пище и воде. Превращение минерального йода в форму, способную включаться в состав органических веществ осуществляется с помощью сложного механизма и может идти лишь в одном органе человеческого организма - щитовидной железе.
В организме человека насчитываются разнообразные гормоны: гормоны щитовидной железы, женские гормоны, мужские гормоны, гормоны крови, гормоны роста, стероидные гормоны, гормоны отвечающие за рост груди, пептидные гормоны и некоторые другие.
Каждый гормон является центральным звеном сложной системы гормональной регуляции. Гормоны синтезируются в виде предшественников, прогормонов, а зачастую и депонируются, в специализированных клетках эндокринных желез. Отсюда они по мере метаболической необходимости поступают в кровоток. Большинство гормонов переносится в виде комплексов с плазматическими белками, так называемыми переносчиками гормонов, причем связывание с переносчиками носит обратимый характер. Гормоны разрушаются соответствующими ферментами, обычно в печени. Наконец, гормоны и продукты их деградации выводятся из организма экскреторной системой, обычно почками. Все перечисленные процессы влияют на концентрацию гормонов и осуществляют контроль за передачей сигналов.
В органах-мишенях имеются клетки, несущие рецепторы, способные связывать гормоны и тем самым воспринимать гормональный сигнал. После связывания гормонов рецепторы передают информацию клетке и запускают цепь биохимических реакций, определяющих клеточный ответ на действие гормона.
Используются в организме для поддержания его гомеостаза, а также для регуляции многих функций (роста, развития, обмена веществ, реакции на изменения условий среды).
Когда гормон, находящийся в крови, достигает клетки-мишени, он вступает во взаимодействие со специфическими рецепторами; рецепторы «считывают послание» организма, и в клетке начинают происходить определенные перемены. Каждому конкретному гормону соответствуют исключительно «свои» рецепторы, находящиеся в конкретных органах и тканях — только при взаимодействии гормона с ними образуется гормон-рецепторный комплекс.
Механизмы действия гормонов могут быть разными. Одну из групп составляют гормоны, которые соединяются с рецепторами, находящимися внутри клеток — как правило, в цитоплазме. К ним относятся гормоны с липофильными свойствами — например, стероидные гормоны (половые, глюко- и минералокортикоиды), а также гормоны щитовидной железы. Будучи жирорастворимыми, эти гормоны легко проникают через клеточную мембрану и начинают взаимодействовать с рецепторами в цитоплазме или ядре. Они слабо растворимы в воде, при транспорте по крови связываются с белками-носителями. Считается, что в этой группе гормонов гормон-рецепторный комплекс выполняет роль своеобразного внутриклеточного реле — образовавшись в клетке, он начинает взаимодействовать с хроматином, который находится в клеточных ядрах и состоит из ДНК и белка, и тем самым ускоряет или замедляет работу тех или иных генов. Избирательно влияя на конкретный ген, гормон изменяет концентрацию соответствующей РНК и белка, и вместе с тем корректирует процессы метаболизма.
Биологический результат действия каждого гормона весьма специфичен. Хотя в клетке-мишени гормоны изменяют обычно менее 1 % белков и РНК, этого оказывается вполне достаточно для получения соответствующего физиологического эффекта.
Большинство других гормонов характеризуются тремя особенностями:
- они растворяются в воде;
- не связываются с белками-носителями;
- начинают гормональный процесс, как только соединяются с рецептором, который может находиться в ядре клетки, ее цитоплазме или располагаться на поверхности плазматической мембраны.
В механизме действия гормон - рецепторного комплекса таких гормонов обязательно участвуют посредники, которые индуцируют ответ клетки. Наиболее важные из таких посредников — ц АМФ (циклический аденозинмонофосфат), инозитолтрифосфат, ионы кальция. Так, в среде, лишенной ионов кальция, или в клетках с недостаточным их количеством действие многих гормонов ослабляется; при применении веществ, увеличивающих внутриклеточную концентрацию кальция, возникают эффекты, идентичные воздействию некоторых гормонов. Участие ионов кальция как посредника обеспечивает воздействие на клетки таких гормонов, как вазопрессин и катехоламины. Однако есть гормоны, у которых внутриклеточный посредник до сих пор не обнаружен. Из наиболее известных таких гормонов можно назвать инсулин, у которого на роль посредника предлагали цАМФ и цГМФ, а также ионы кальция и даже перекись водорода, но убедительных доказательств в пользу какого-нибудь одного вещества до сих пор нет. Многие исследователи считают, что в таком случае посредниками могут выступать химические соединения, структура которых полностью отличается от структуры уже известных науке посредников.
Выполнив свою задачу, гормоны либо расщепляются в клетках-мишенях или в крови, либо транспортируются в печень, где расщепляются, либо, наконец, удаляются из организма в основном с мочой (например, адреналин).
Общие свойства гормонов:
- Строгая специфичность физиологического действия.
- Высокая биологическая активность: гормоны оказывают свое физиологическое действие в чрезвычайно малых дозах.
- Дистантный характер действия: клетки-мишени располагаются обычно далеко от места образования гормона.
- Многие гормоны (стероидные и производные аминокислот) не имеют видовой специфичности.
- Генерализованность действия.
- Пролонгированность действия.
30. Біологічні мембрани. Функції, будова. Будова ліпідного біслоя, типи зв`язків та рух його окремих компонентів. Білки мембран. Механізми трансмембранного переносу.
Кле́точная мембра́на (или цитолемма, или плазмалемма, или плазматическая мембрана) отделяет содержимое любой клетки от внешней среды, обеспечивая ее целостность; регулируют обмен между клеткой и средой; внутриклеточные мембраны разделяют клетку на специализированные замкнутые отсеки — компартменты или органеллы, в которых поддерживаются определенные условия внутриклеточной среды.
Плазматическая мембрана, или плазмалемма, — наиболее постоянная, основная, универсальная для всех клеток мембрана. Она представляет собой тончайшую (около 10 нм) пленку, покрывающую всю клетку. Плазмалемма состоит из молекул белков и фосфолипидов. Все биомембраны построены одинаково; они состоят из двух слоев липидных молекул толщиной около 6 нм, в которые встроены белки. Некоторые мембраны содержат, кроме того, углеводы, связанные с липидами и белками. Соотношение липиды: белки: углеводы является характерным для клетки или мембраны и существенно варьирует в зависимости от типа клеток или мембран. Компоненты мембран удерживаются нековалентными связями, вследствие чего они обладают лишь относительной подвижностью, т. е. могут диффундировать в пределах липидного бислоя. Текучесть мембран зависит от липидного состава и температуры окружающей среды. С увеличением содержания ненасыщенных жирных кислот текучесть возрастает, так как наличие двойных связей способствует нарушению полукристаллической мембранной структуры. Подвижными являются и мембранные белки. Если белки не закреплены в мембране, они «плавают» в липидном бислое как в жидкости. Поэтому говорят, что биомембраны имеют жидкостно-мозаичную структуру.
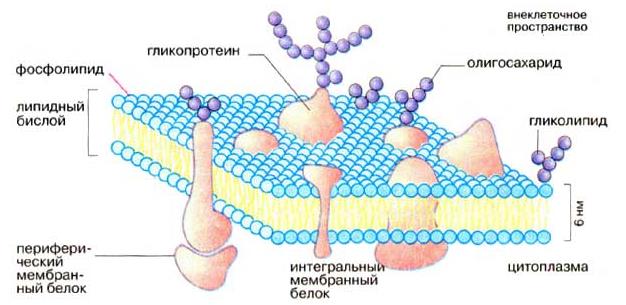
Биомембраны и их составляющие выполняют следующие функции:
1. Ограничение и обособление клеток и органелл. Обособление клеток от межклеточной среды обеспечивается плазматической мембраной, защищающей клетки от механического и химического воздействий. Плазматическая мембрана обеспечивает также сохранение разности концентраций метаболитов и неорганических ионов между внутриклеточной и внешней средой.
2. Контролируемый транспорт метаболитов и ионов определяет внутреннюю среду, что существенно для гомеостаза, т.е. поддержания постоянной концентрации метаболитов и неорганических ионов, и других физиологических параметров. Регулируемый и избирательный транспорт метаболитов и неорганических ионов через поры и посредством переносчиков становится возможным благодаря обособлению клеток и органелл с помощью мембранных систем.
3. Восприятие внеклеточных сигналов и их передача внутрь клетки, а также инициация сигналов.
4. Ферментативный катализ. В мембранах на границе между липидной и водной фазами локализованы ферменты. Именно здесь происходят реакции с неполярными субстратами. Примерами служат биосинтез липидов и метаболизм неполярных ксенобиотиков. В мембранах локализованы наиболее важные реакции энергетического обмена, такие, как окислительное фосфорилирование и фотосинтез.
5. Контактное взаимодействие с межклеточным матриксом и взаимодействие с другими клетками при слиянии клеток и образовании тканей.
6. Заякоривание цитоскелета, обеспечивающее поддержание формы клеток и органелл и клеточной подвижности.
Липидный бислой - это основная структура мембраны, которая создает относительно непроницаемый барьер для большинства водорастворимых молекул. Липидный бислой - основа мол. организации мембран биологических. Легко формируется липидами, у к-рых невелики различия между площадью поперечного сечения головки и углеводородных цепей. Это свойственно большинству фосфолипидов биол. мембран. Характерный признак липидов, образующих липидный бислой, - низкая величина критич. концентрации мицеллообразования (ок. 10-10 М). Толщина липидного бислоя определяется прежде всего длиной углеводородных цепей и обычно находится в пределах 4-5 нм. Присутствие в цепях цис-двойных связей, боковых метильных групп и др. заместителей нарушает плотность упаковки молекул и приводит к уменьшению толщины бислоя. В зависимости от т-ры липидный бислой может находиться в двух состояниях - кристаллическом (гелевом) и жидкокристаллическом.
Протеины могут связываться с мембраной различным путем.
Интегральные мембранные белки имеют трансмембранные спирализованные участки (домены), которые однократно или многократно пересекают липидный бислой. Такие белки прочно связаны с липидным окружением.
Периферические мембранные белки удерживаются на мембране с помощью липидного «якоря» и связаны с другими компонентами мембраны; например, они часто бывают ассоциированы с интегральными мембранными белками.
У интегральных мембранных белков фрагмент пептидной цепи, пересекающий липидный бислой, обычно состоит из 21-25 преимущественно гидрофобных аминокислот, которые образуют правую α-спираль с 6 или 7 витками (трансмембранная спираль).
Простейшей формой транспорта через биомембраны является свободная диффузия (облегченная диффузия). Она часто облегчается определенными мембранными белками, которые можно разделить на две группы:
1. Канальные белки образуют в биомембранах заполненные водой поры, проницаемые для определенных ионов. Например, имеются специфические ионные каналы для ионов Na+, К+, Са2+ и Cl-.
2. В отличие от ионных каналов транспортные белки избирательно связывают молекулы субстрата и за счет конформационных изменений переносят их через мембрану. В этом отношении транспортные белки (белки-переносчики, пермеазы) похожи на ферменты. Единственное различие состоит в том, что они «катализируют» направленный транспорт, а не ферментативную реакцию. Они проявляют специфичность - иногда групповую - к субстратам, подлежащим переносу. Кроме того, для них характерны определенное сродство, выражаемое в виде константы диссоциации Kd и максимальная транспортная способность V. Свободная диффузия и транспортные процессы, обеспечиваемые ионными каналами и переносчиками, осуществляются по градиенту концентрации или градиенту электрическою заряда (называемым вместе электрохимическим градиентом). Такие механизмы транспорта классифицируются как «пассивный транспорт». Некоторые тран
 2015-04-30
2015-04-30 1166
1166