Стехиометрические реакции горения. Для решения технических задач, связанных со сжиганием топлива, необходимо уметь сводить материальные балансы по стехиометрическим уравнениям.
Продуктами полного сгорания топлива является двуокись углерода СО2, сернистый газ SO2 и водяные пары Н2О. Кроме того, компонентами продуктов сгорания топлива являются азот N2, содержавшийся в атмосферном воздухе, и избыточный кислород О2. Наличие в продуктах сгорания кислорода связано с тем, что процесс горения протекает не идеально, поэтому требуется подавать его больше, чем теоретически необходимо.
По уравнениям реакций окисления горючих элементов топлива, зная их молекулярную массу, плотность и объемы, можно найти массу и теоретический (стехиометрический) объем воздуха и продуктов полного сгорания. Наиболее удобно проводить расчеты, исходя из значений массы молекул (молей), величины которых для горючих элементов топлива приведены в табл. 4.4.
При полном сгорании углерода
С + О2 = СО2; (4.31)
12,0 кг С + 32,0 кг О2 = 44,0 кг СО2
|
|
|
или
1 кг С + 32/12 кг О2 = 44/12 кг СО2,
чему соответствует
1 кг С + 2,67 кг О2 = 3,67 кг СО2, (4.32)
1 кг С + (2,67/ 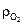 ) м3 О2 = (3,67/
) м3 О2 = (3,67/ 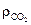 ) м3 СО2 ,
) м3 СО2 ,
т. е. при сжигании 1 кг углерода требуется 1,866 м3 кислорода (при 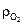 = 1,428 кг/м3) и образуется 1,866 м3 двуокиси углерода (при
= 1,428 кг/м3) и образуется 1,866 м3 двуокиси углерода (при 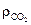 = 1,964 кг/м3).
= 1,964 кг/м3).
При окислении - горении водорода:
2Н2 + О2 = 2Н2О; (4.33)
1 кг Н2 + 8 кг О2 = 9 кг Н2О;
т. е. при полном сгорании 1 кг водорода требуется 5,60 м3 кислорода и образуется 11,20 м3 водяного пара.
Аналогично при горении летучей серы:
S + O2 = SO2; (4.34)
32,0 кг + 32,0 кг О2 = 64,0 кг SО2;
1 кг S +1 кг О2 = 2 кг SО2.
Для полного сгорания 1 кг серы требуется 0,70 м3 кислорода и образуется 0,70 м3 сернистого газа.
Таблица 4.4
 2015-04-20
2015-04-20 248
248







