Лабораторная работа №6
Комплексонометрия – метод объемного анализа, в основе которого лежат реакции комплексообразбвания. В качестве рабочего раствора (титранта) используется раствор хелатообразующего лиганда – комплексона, который в присутствии аммиачной буферной смеси образует с катионами металлов комплексные соединения в анализируемом растворе. Самый распространенный комплексон, который используется в аналитической практике – комплексон III, динатриевая соль этилендиаминтетрауксусной кислоты (см. лекционный материал), раствор которого называют трилон Б. условное обозначение Na2H2Y.
Определение общей жесткости воды, обусловленное присутствием в ней ионов Са2+ и Mg2+, основано на реакции: H2Y2- + Me2+(Ca2+,Mg2+) 1 MeY2- + 2H+
Структура комплексного соединения MeY2: 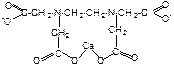
Очевидно, что образование хелата сопровождается обменной реакцией между двумя протонами двух карбоксильных групп на ион Ме2+. Следовательно число эквивалентности (Z) равно 2 для трилона Б и для иона металла. В присутствии аммиачной буферной смеси не происходит подкисление раствора выделяемыми протонами Н+.
|
|
|
Жесткость воды (Ж) выражается количеством миллимоль – эквивалентов ионов кальция и магния в литре исследуемого раствора:
Жесткость (Ж) 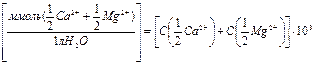
Санитарная норма - Ж<7 ммоль/л; мягкая вода - Ж<2 ммоль/л.
В точке эквивалентности выполняется закон эквивалентов: 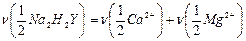 ;
;
с учетом концентрации стандартного раствора и его объема израсходованного на титрование:
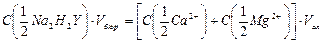 , откуда
, откуда 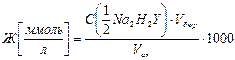
Титрование выполняют в присутствии аммонийного (аммиачного) буферного раствора. Точку конца титрования определяют с помощью металлоорганических индикаторов (металлохромных индикаторов), которые образуют с определяемыми катионами при тех же условиях окрашенные комплексные соединения, менее устойчивые, чем комплексы с титрантом трилоном Б.
В точке эквивалентности комплекс металла с индикатором разрушается, т.к. образуется более устойчивый комплекс катиона металла с трилоном Б, и индикатор выделяется в раствор, что приводит к резкому изменению окраски раствора: раствор приобретает окраску, обусловленную свободным индикатором.
При определении жесткости воды используют индикатор эриохром черный – Т (ЭХЧ-Т) – это сложная трехосновная органическая кислота, которая в зависимости от рН раствора образует по-разному окрашенные ионы:
H3Ind 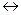 H2Ind-
H2Ind- 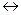 HInd2-
HInd2- 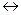 Ind3-
Ind3-
pH 6,3 6,3-11,2 >11,2
красный синий желтый
 2015-05-10
2015-05-10 2777
2777







