При исследовании электрохимических равновесий встаёт задача определения электродных потенциалов различных металлов друг относительно друга. Определить потенциал на фазовой границе электрод-раствор принципиально невозможно, не опустив в раствор второй электрод, связанный со внешней электрической цепью. Следовательно, мы измеряем не электродный потенциал, данного металла, а ЭДС гальванического элемента. Поэтому необходимо стандартизировать второй электрод – электрод сравнения. В качестве эталонного электрода договорились использовать нормальный (стандартный) водородный электрод. Он представляет собой платиновую пластинку, покрытую тонким слоем высокодисперсной платины (платиновой чернью), обладающую большой удельной поверхностью. Платиновый электрод помещён в сосуд, наполненный раствором соляной или серной кислоты с активностью, равной 1моль/л. Электрод омывается током водорода, который поступает в раствор под атмосферным давлением 2, 3 (Рис.2), сосуд имеет специальный отвод 1, снабжённый электролитическим ключом (устройством, обеспечивающим электрический контакт между двумя растворами без их смешения), для соединения нормального водородного электрода со вторым полуэлементом.
|
|
|
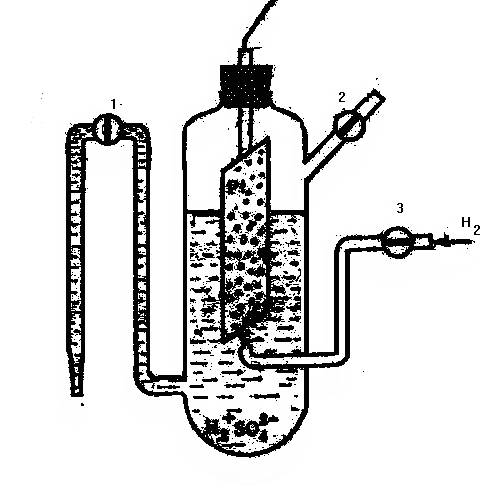
Рис.2 Нормальный водородный электрод.
Температуру системы поддерживают равной 293К (200С). Платина, поверхность которой насыщена водородом, является водордным электродом, обратимым относительно иона водорода. На поверхности платины протекают процессы: Н2 =2Н и Н =Н+ +е-; суммарная реакция:
Н2 =2Н+ +2е-
Существуют и другие газовые электроды, но добиться воспроизводимого значения их потенциала гораздо сложнее, поэтому они не используются в качестве электродов сравнения. На практике для этой цели используют хлорсеребряный электрод: Ag|AgCl, Cl-. Электроды, на поверхности которых тонким слоем осаждено труднорастворимое соединение, называются электродами второго рода.
 2015-05-20
2015-05-20 1404
1404








