Окислительно-восстановительные реакции в растворах электролитов протекают с изменением зарядов или окислительных чисел взаимодействующих в растворе ионов (см. гл. VII). Например, к реакциям
подобного типа относятся:
Fе2+ =.FeЗ++е- (а)
Сr3++4Н2О=СгО42-+8Н++Зе- (б)
Если поместить платину или другой инертный электрод (не посылающий собственных ионов) в раствор электролита, в котором происходит окислительно-восстановительная реакция, то на границе инертного электрода (принимающего или отдающего электроны) и раствора возникает скачок потенциала Еов (индекс "ов" или "RedOx" значит окислительно-восстановительный), величина которого может быть вычислена по следующей формуле:
Е=Е0ов+RT/nF ln K' (7)
где R, Т и F имеют те же значения, что и раньше; n — число электронов, отдаваемых инертному электроду при протекании окислительно-восстановительной реакции [например, 1 для реакции (а) и З для реакции (б)]; K' представляет собой отношение действительных (в общем случае не равновесных) концентраций участвующих в реакции веществ в тот момент, когда определяется Еов. При Т=293,2° получаем следующие выражения Еов для реакций (а) и (б):
|
|
|
Eов=E°ов+0,0582lg [Fe2+]/[Fe3+] (а)
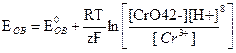 (б)
(б)
Очевидно, что Е°ов — стандартный потенциал окислительно-восстановительной реакции при концентрации каждого из ионов, участвующих в реакции, равной 1 моль/л. Чем меньше окислительно-восстановительный потенциал Еов (чем более отрицательным является значение Еов), тем легче вещество теряет свои электроны и большей восстановительной активностью обладает. Чем больше окислительно-восстановительный потенциал Еов, тем выше окислительная активность вещества (см. табл.).
На основе величин окислительно-восстановительных потенциалов можно определить ЭДС окислительно-восстановительной реакции, а следовательно, и её направление. Окислительно-восстановительная реакция в данном направлении может протекать при условии положительного значения ЭДС. Рассмотрим реакцию:
5Nа2S+403 + 2КМn04 + ЗН2S04 = 5Na2S+6O4 + K2SO4 + MnSO4 + 3 H2O
составим ионно-электронные полуреакции восстановления и окисления:
Мn04- + 8Н+ + 5е- = 2Мn2+ + 4Н2O | 2 (Е01 = 1,63 в)
S032- + Н2O = S042- + 2Н+ +2е- | 5 (Е02 = 0,20 в)
Для данной реакции ЭДС = Е01 - Е02 = 1,63— 0,20 = +1,43 в
Следовательно, сульфит натрия окисляется в кислой среде перманганатом калия до сульфата.
 2015-05-20
2015-05-20 1091
1091








