На вакантные места в П+700 переходят электроны с Пц, и нециклическая цепь переноса электронов таким образом замыкается. Z-схема убедительно объясняет «эффект усиления Эмерсона», так как только при совместном использовании коротковолновых (ФС II) и длинноволновых (ФС I) лучей красного света интенсивность фотосинтеза будет оптимальной.
Энергия, освобождающаяся при движении электронов от П680 (Е'0 = -0,8 В) до П700 (Е'о = +0,4 В), используется для синтеза АТР из ADP и неорганического фосфата (фото-фосфорилирование).
Наряду с нециклическим в мембранах хлоропластов функционирует циклический транспорт электронов, включающий в себя только ФС I и комплекс цитохромов b6 —ƒ. В этом случае возбужденные молекулы П*700последовательно отдают электроны на А1 А2, Ав, Фд, PQ, цитохром b6, FeSR, цитохром ƒ, Пц и, наконец, П700. При этом NADP+ не восстанавливается. Освобождающаяся энергия используется для фосфорилирования ADP (рис. 3.10).
 |
Интересно отметить, что комплекс цитохромов b6 — f функционирует в системе транспорта электронов при фотосинтезе аналогично комплексу III (цит. b, с1) в митохондриях (см. рис. 4.7).
• Разница в уровнях энергии между П680 и П700 (> 50 кДж) вполне достаточна для фосфорилирования ADP, так как величина высокоэнергетической фосфатной связи АТР равна 30,6 кДж/моль (7,3 ккал). Перепады энергии в ФС I еще значительнее. Однако само по себе освобождение энергии при нециклическом и циклическом транспорте электронов не объясняет, каким образом осуществляется фотофосфорилирование.
Механизм фосфорилирования ADP, сопряженного с деятельностью электронтранспортной цепи, объясняет хемиосмоти-

ческая теория, разработанная английским биохимиком П. Митчеллом (1961 — 1966). Для объяснения процессов фотофосфори-лирования эта теория была впервые использована А. Ягендор-фом (1967).
Сущность хемиосмотической теории состоит в следующем. Цепь переносчиков электронов и протонов, действующая в соответствии с окислительно-восстановительным градиентом, перешнуровывает мембрану таким образом, что трансмембранный перенос е- и Н+ в одну сторону чередуется с переносом в обратную сторону только е-. В результате функционирования такого механизма (Н+-помпы) по одну сторону мембраны накапливается избыток Н+ и возникает электрохимический (т. е. электрический и концентрационный) потенциал ионов Н+ (см. 1.1.1), который служит формой запасания энергии. Обратный пассивный ток ионов Н+ через протонный канал Н+-АТРазы, получивший название сопрягающего фактора CF1 сопровождается образованием высокоэнергетической фосфатной связи АТР.
На рис. 3.11 представлена упрощенная схема расположения переносчиков в мембране тилакоидов, объясняющая механизм фотофосфорилирования. На внутренней стороне мембраны тилакоида под действием света возбуждаются П680 и П700- Электроны от П680 захватываются акцепторами е- на наружной стороне и передаются на окисленную форму пластохинона (PQ) — липидорастворимого переносчика протонов и электронов, выполняющего функцию челнока. Принимая два электрона, 2PQ диффундируют к цитохромному комплексу и захватывают из стромы 2Н+. Электроны с 2PQH2 поступают в цепь: FeSR → цит. f → Пц→ П700,а ионы Н+ попадают в полость тилакоида. Вторая пара ионов Н + освобождается там же при фотоокислении воды. В ФС I электроны П700 захватываются акцептором А, передаются ферредоксину и затем NADP+ на наружной стороне-мембраны, причем 1Н+ используется на восстановление NADP.
Таким образом, из среды, окружающей тилакоид, при поглощении пигментами квантов света исчезают, а во внутренней полости тилакоида появляются протоны. В результате на мембране возникает электрохимический потенциал ионов Н+ , который затем используется для фосфорилирования ADP. Этот процесс называется нециклическим фотофосфорилированием.
 При циклическом фотофосфорилировании, когда функционирует только ФСI, электроны от Фд поступают на цитохромный комплекс с использованием пула PQ, который действует как переносчик электронов и протонов. Затем электроны через цитохром ƒ и Пц возвращаются на основной энергетический уровень в П700, а протоны поступают в полость тилакоида. Возникновение
При циклическом фотофосфорилировании, когда функционирует только ФСI, электроны от Фд поступают на цитохромный комплекс с использованием пула PQ, который действует как переносчик электронов и протонов. Затем электроны через цитохром ƒ и Пц возвращаются на основной энергетический уровень в П700, а протоны поступают в полость тилакоида. Возникновение 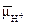 обеспечивает затем синтез фосфатной связи АТР в СF1. Более подробно механизмы фосфорилирования, сопряженные с электрон-транспортной цепью и Н+-помпой, будут рассмотрены в разделе 4.3.2.
обеспечивает затем синтез фосфатной связи АТР в СF1. Более подробно механизмы фосфорилирования, сопряженные с электрон-транспортной цепью и Н+-помпой, будут рассмотрены в разделе 4.3.2.
• Белковые комплексы, участвующие в фотохимическихреакциях фотосинтеза, в мембранах хлоропластов распределены неравномерно. Наибольшие различия наблюдаются между теми мембранами, которые плотно состыкованы друг с другом в гранах и теми участками мембран, которые контактируют со стромой (закругленные участки тилакоидов гран и мембраны тилакоидов стромы).
Светособирающий комплекс и пигмент- белковый комплекс ФС II находятся в основном в мембранах, плотно контактирующих друг с другом, причем ССК играет особую роль в адгезии тилакоидных мембран (рис. 3.12). Показано, что у мутанта хламидомонады, лишенного белка, с которым связан хлорофилл b, граны не образуются. ФС I со своим светособираюгцим комплексом преимущественно, а АТРазный комплекс (СF1 + CF0), как правило, находятся на несостыкованных участках мембран. Комплекс цитохромов b6 — f равномерно распределен как в состыкованных, так и в несостыкованных мембранах. Такое распределение белковых комплексов, участвующих в световой фазе фотосинтеза, ставит вопрос о способе их взаимодействия. Показано, что это взаимодействие осуществляется с помощью легкоподвижного липофильного пластохинона PQ в липидной фазе и благодаря перемещению водорастворимого пластоцианина вдоль внутренних поверхностей ламелл и водорастворимого ферредоксина вдоль их наружных поверхностей.
К латеральным перемещениям вдоль мембраны способны и сами белковые комплексы. На это передвижение влияет величина их электрического заряда. Например, восстановление пластохинона PQ фотосистемой II приводит к активации киназы и фосфорилированию ССКa-b. Фосфорилирование ССК увеличивает его отрицательный заряд, что способствует перемещению ССК в стромальную область мембраны и возрастанию миграции поглощенной энергии света к ФС I. Возросшая фотохимическая активность ФС I усиливает окисление PQ, что, в свою очередь, приводит к инактивации киназы, фосфатаза же дефосфорилирует ССК. Таким образом, обратимое фосфорилирование ССК представляет собой петлю обратной связи в системе взаимной регуляции
активности ФС I и ФС II. Механизм такой регуляции включает латеральный транспорт белковых комплексов в мембранах хлоропластов.

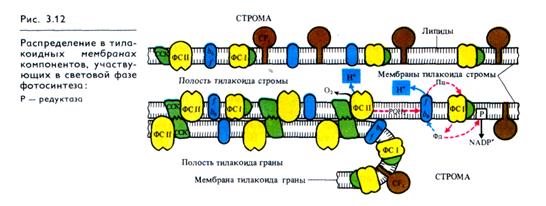
 В результате фотохимических реакций в хлоропластах создается необходимый уровень АТР и NADPH. Эти конечные продукты световой фазы фотосинтеза стоят на входе в темно-вую фазу, где СО2 восстанавливается до углевода:
В результате фотохимических реакций в хлоропластах создается необходимый уровень АТР и NADPH. Эти конечные продукты световой фазы фотосинтеза стоят на входе в темно-вую фазу, где СО2 восстанавливается до углевода:
Однако сами по себе АТР и NADPH не в состоянии восстановить СО2. Очевидно, и темновая фаза фотосинтеза — сложный процесс, включающий большое количество реакций. Кроме того, существуют различные пути восстановления СО2. В настоящее время известны так называемые С3-путь и С4-путь фиксации СО2, фотосинтез по типу толстянковых (САМ-метаболизм) и фотодыхание. Рассмотрим каждый из этих путей в отдельности.
Этот способ ассимиляции СО2, присущий всем растениям, в 1946—1956 гг. был расшифрован американским биохимиком М. Кальвином и его сотрудниками. Прежде всего была поставлена задача обнаружить первичный продукт фотосинтеза и выяснить, какое соединение служит акцептором СО2.
Для решения первого вопроса были использованы одноклеточные зеленые водоросли (хлорелла и др.) и меченый 14СОг. Фотоси1нтезируюшие водоросли помещали в среду, содержащую 14СО2, на разные промежутки времени, затем клетки быстро фиксировали, экстрагировали из них спиртораствори-мые вещества и определяли содержание 14С в различных соединениях после их разделения с помощью хроматографии.
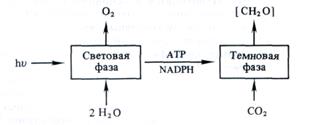
Оказалось, что после экспозиции в течение 1 мин 14С включался в С3 —С7-сахара и фосфосахара, в органические кислоты (яблочную, щавелевоуксусную, ФЕП), в аминокислоты (аланин, аспарагиновую кислоту). Если же время экспозиции было сокращено до 0,1—2 с, то большая часть метки обнаруживалась в фосфоглицериновой кислоте, в ее карбоксильной группе:
Следовательно, 3-фосфоглицериновая кислота (ФГК) является первичным продуктом фотосинтеза.
Второй вопрос - природа первичного акцептора СО2. Сначала предположили, что таким акцептором является какое-либо двухуглеродное соединение. Однако введение в инкубационную среду винилфосфата, фосфогликольальдегида и других веществ с С2 не приводило к увеличению содержания радиоактивной метки из СО2 в ФГК. Тогда схему опыта видоизменили следующим образом. Водоросли экспонировали на свету при высокой (1 %-ной) концентрации СО2, затем резко снижали его концентрацию до 0,003%. Расчет был на то, что в условиях дефицита СО2 быстро накопится именно то соединение, которое служит акцептором СО2. С помощью двумерной хроматографии удалось установить, что при отсутствии возможности карбоксилирования в клетках кратковременно возрастает концентрация рибулозо-1,5-дифосфата (рибулозо-1,5-бисфосфата). Отсюда возникло предположение, что первичная фиксация СО2 происходит следующим образом: С5 + СО2→C6→2С3. Для проверки этой гипотезы в бесклеточный экстракт из листьев шпината или клеток хлореллы вносили меченный по 32Р рибулозо-1,5-дифосфат. На свету в экстракте появлялась радиоактивная ФГК.
На основании полученных данных процесс первичной фиксации СО2 можно записать следующим образом:
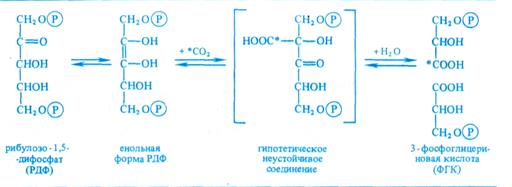
Эта реакция катализируется рибулозодифосфаткарбоксилазой (рибулозобисфосфаткарбоксилазой; другие названия — белок фракции I, карбоксидисмутаза). Максимум активности фермент имеет при рН 7,8 — 8,0 и нуждается в присутствии ионов Mg2+. Дальнейшая работа в лаборатории Кальвина и в других лабораториях привела к расшифровке всех последующих реакций С3-пути фотосинтеза, который получил название цикла Кальвина (рис. 3.13). Этот цикл, весьма напоминающий обращенный пентозофосфатный путь дыхания (см. 4.2.5), состоит из трех этапов: карбоксилирования, восстановления и регенерации.
1. Карбоксилирование. Молекулы рибулозо-5-фосфа-та фосфорилируются с участием АТР и фосфорибуло-зокиназы, в результате чего образуются молекулы рибулозо-1,5-дифосфата, к которым в свою очередь присоединяется СО2 с помощью рибулозодифосфаткарбоксилазы. Полученный продукт расщепляется на две триозы: 2 молекулы 3-фосфо-глицериновой кислоты (3-ФГК).
2. Фаза восстановления. 3-ФГК восстанавливается до 3-фосфоглицеринового альдегида (3-ФГА) в два этапа. Сначала происходит фосфорилирование 3-ФГК при участии АТР и фосфоглицераткиназы до 1,3-дифосфоглицериновой кислоты, а затем восстановление 1,3-ФГК с помощью NADPH и дегидрогеназы фосфоглицеринового альдегида.
3. Фаза регенерации первичного акцептора диоксида углерода и синтеза конечного продукта фотосинтеза. В результате описанных выше реакций при фиксации трех молекул СО2 и образовании шести молекул восстановленных 3-фосфотриоз пять из них используются затем для регенерации рибулозо-5-фосфата, а один — для синтеза глюкозы. 3-ФГА под действием триозофосфатизомеразы изомеризуется в фосфодиокси-ацетон. При участии альдолазы 3-ФГА и фосфодиоксиацетон конденсируются с образованием фруктозо-1,6-дифосфата, у которого отщепляется один фосфат с помощью фруктозо-1,6-дифосфатазы. В дальнейших реакциях, связанных с регенерацией первичного акцептора СО2, последовательно принимают участие транскетолаза и альдолаза. Транскетолаза катализирует перенос содержащего два углерода гликолевого альдегида от кетозы на альдозу:
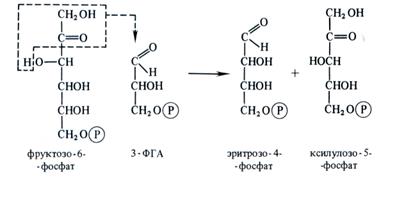
Альдолаза затем осуществляет перенос трехуглеродного остатка фосфодиоксиацетона на альдозу, в данном случае на эритрозо-4-фосфат, в результате чего синтезируется седо-гептулозо-1,7-дифосфат. Последний дефосфорилируется и под действием транскетолазы из него и 3-ФГА образуются ксилулозо-5-фосфат и рибозо-5-фосфат. Две молекулы ксилуло-зо-5-фосфата при участии рибулозофосфатэпимеразы и одна молекула рибозо-5-фосфата с участием рибозофосфатизомеразы превращаются в три молекулы рибулозо-5-фосфата, с которого начинается новый цикл фиксации СО2.
Из оставшейся неиспользованной 6-й молекулы 3-ФГА под действием альдолазы синтезируется (при повторении цикла) молекула фруктозе-1,6-дифосфата, из которой могут образовываться глюкоза, сахароза или крахмал:
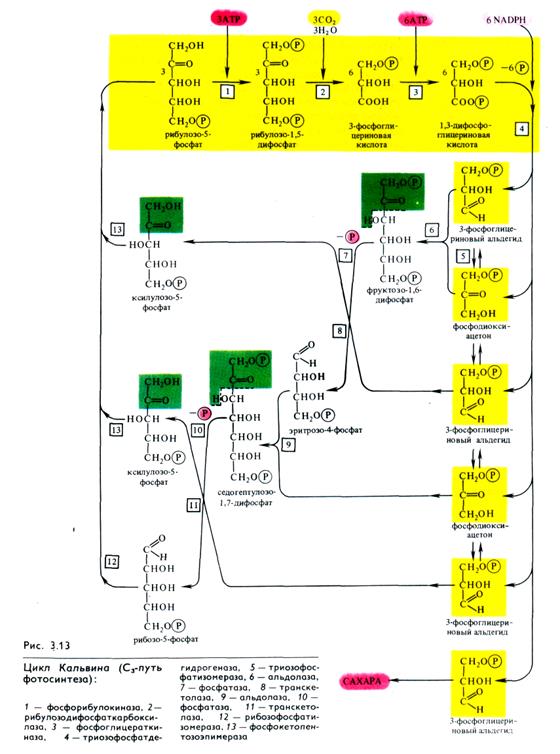

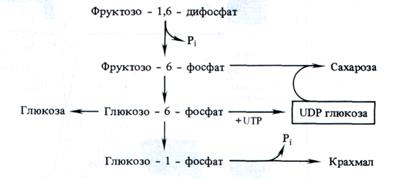
Таким образом, для синтеза одной молекулы глюкозы в цикле Кальвина необходимы 12 NADPH и 18 АТР (рис. 3.13), которые поставляются в результате фотохимических реакций фотосинтеза.
В работах Л. А. Незговоровой (1956-1957 гг.), было установлено, что при коротких экспозициях листьев кукурузы на свету 14С из 14СО2 обнаруживается в аспарагиновой кислоте. В дальнейших исследованиях как советских, так и зарубежных специалистов эти представления были развиты, что привело к открытию С4-пути углерода в фотосинтезе. Так, в 1960 г. Ю. С. Карпилов, а в 1963 г. И. А. Тар-чевский и Ю. С. Карпилов представили данные о раннем образовании яблочной кислоты в листьях кукурузы. Г. П. Корчак и др. (Kortschak et al., 1965) впервые показали, что дикар-боновые кислоты (яблочная и аспарагиновая) являются первичными продуктами фиксации СО2 у сахарного тростника. Затем эти соединения через 3-ФГК и гексозофосфаты превращаются в сахара. Как новый тип фиксации СО2, принципиально отличающийся от цикла Кальвина, этот цикл впервые описали австралийские ученые М. Д. Хетч и К. Р. Слэк (1966). К группе растений с С4-путем фотосинтеза относятся сахарный тростник, кукуруза, сорго и др. Листья этих растений содержат два разных типа хлоро-пластов: хлоропласты обычного вида — в клетках мезофилла и
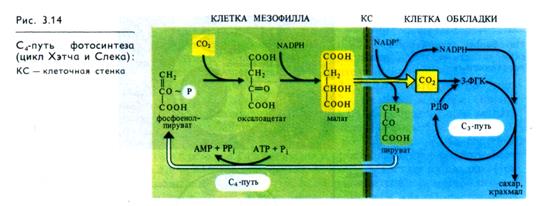
 большое количество крупных хлоропластов, часто не имеющих гран,— в клетках, окружающих проводящие пучки (обкладка). СО2, диффундирующий в лист через устьица, попадает в цитоплазму клеток мезофилла, где при участии ФЕП-карбокси-лазы вступает в реакцию с ФЕП, образуя щавелево-уксусную кислоту (оксалоацетат). Затем уже в хлоропластах оксалоацетат восстанавливается до яблочной кислоты (малата) за счет NADPH, образующего в ходе световой фазы фотосинтеза (рис. 3.14). Щавелевоуксусная кислота в присутствии NH4 может превращаться также в аспартат. Затем малат (или аспартат) переносится в хлоропласты клетки обкладки сосудистого пучка, где он декарбоксилируется малик-энзимом (малатдегидрогеназой декарбоксилирующей) до пирувата и СО2.
большое количество крупных хлоропластов, часто не имеющих гран,— в клетках, окружающих проводящие пучки (обкладка). СО2, диффундирующий в лист через устьица, попадает в цитоплазму клеток мезофилла, где при участии ФЕП-карбокси-лазы вступает в реакцию с ФЕП, образуя щавелево-уксусную кислоту (оксалоацетат). Затем уже в хлоропластах оксалоацетат восстанавливается до яблочной кислоты (малата) за счет NADPH, образующего в ходе световой фазы фотосинтеза (рис. 3.14). Щавелевоуксусная кислота в присутствии NH4 может превращаться также в аспартат. Затем малат (или аспартат) переносится в хлоропласты клетки обкладки сосудистого пучка, где он декарбоксилируется малик-энзимом (малатдегидрогеназой декарбоксилирующей) до пирувата и СО2.
Как уже отмечалось, в хлоропластах обкладки отсутствуют граны, а следовательно, слабо представлена ФС II, необходимая для нециклического транспорта электронов, однако в них в изобилии накапливается крахмал. Объясняется это тем, что в хлоропластах обкладки используется поставляемый малик-энзимом NADPH, а также тот СО2, который образовался при окислительном декарбоксилировании малата (или аспартата). В этих хлоропластах в процессе циклического фото-фосфорилирования синтезируется большое количество АТР и фиксация СО2 осуществляется по типу цикла Кальвина. У некоторых растений с С4-путем фотосинтеза (амарант, лебеда) яблочная кислота декарбоксилируется в митохондриях клеток обкладки с восстановлением NAD.
Возникающий при расщеплении малата в хлоропластах клеток обкладки пируват перемещается назад в хлоропласты клеток мезофилла (рис. 3.14), где может снова превращаться в первичный акцептор СО2 — ФЕП. Такая компартментация процессов позволяет растениям с С4-путем осуществлять фотосинтез даже при закрытых устьицах, так как хлоропласты клеток обкладки используют малат (аспартат), образовавшийся ранее, как донор СО2, С4-растения могут также использовать СО2, возникающий при фотодыхании (см. дальше). Закрывание устьичных отверстий в наиболее жаркое время дня сокращает потери воды за счет испарения (транспирации). Не удивительно поэтому, что к С4-растениям относятся  многие виды засушливой тропической зоны. Растения с С4-путем фотосинтеза, как правило, устойчивы к засолению. Эффективность использования воды, т. е. отношение массы ассимилированного СО2 к массе воды, израсходованной при транспирации, у С4-растений зачастую вдвое выше, чем у С3-растений. Таким образом, С4-растения имеют преимущества перед С3-растениями в засушливых местах обитания благодаря высокой интенсивности фотосинтеза даже при закрытых устьицах. Фиксация СО2 с участием ФЕП и образование малата (аспартата) служит как бы насосом для поставки СО2 в хлоропласты обкладки, функционирующие по С3-пути.
многие виды засушливой тропической зоны. Растения с С4-путем фотосинтеза, как правило, устойчивы к засолению. Эффективность использования воды, т. е. отношение массы ассимилированного СО2 к массе воды, израсходованной при транспирации, у С4-растений зачастую вдвое выше, чем у С3-растений. Таким образом, С4-растения имеют преимущества перед С3-растениями в засушливых местах обитания благодаря высокой интенсивности фотосинтеза даже при закрытых устьицах. Фиксация СО2 с участием ФЕП и образование малата (аспартата) служит как бы насосом для поставки СО2 в хлоропласты обкладки, функционирующие по С3-пути.
 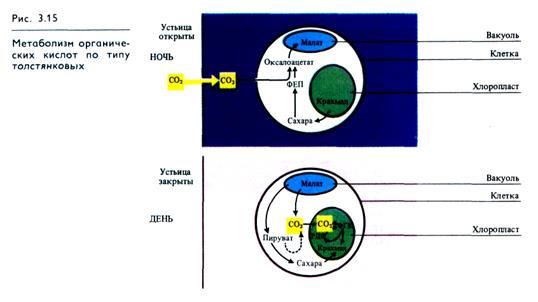 |
Суккуленты (роды Crassula, Bryophyllum и др.) также приспособились осуществлять фотосинтез в условиях резко засушливого климата. Для них характерен суточный цикл метаболизма С4-кислот с образованием яблочной кислоты ночью. В соответствии с английским выражением crassulacean acid metabolism (CAM) этот тип фотосинтеза часто сокращенно называют САМ-метаболиэм. Устьица этих растений днем обычно закрыты, что предотвращает потерю воды, и открываются ночью. СО 2 поступает в листья, где при участии содержащейся в цитоплазме ФЕП-карбоксилазы взаимодействует с фосфоенолпируватом, образуя оксалоацетат. Источником ФЕП служит крахмал. То же самое происходит и с СО2, который освобождается в клетках в процессе дыхания. Образовавшийся оксалоацетат восстанавливается под действием NADH-зависимой малатдегидрогеназы до яблочной кислоты, которая накапливается в вакуолях клеток листа (рис. 3.15). Это приводит к закислению клеточного сока в ночное время. Как и у С4-растений, оксалоацетат может быть источником аспартата, однако этот путь здесь менее выражен.
Днем в условиях высокой температуры, когда устьица  закрыты, малат транспортируется из вакуолей в цитоплазму и там декарбоксилируется при участии малатдегидрогеназы декарбоксилирующей (малик-энзима) с образованием СО2 и пирувата. СО2 поступает в хлоропласты и включается в них в цикл Кальвина, участвуя в синтезе Сахаров.
закрыты, малат транспортируется из вакуолей в цитоплазму и там декарбоксилируется при участии малатдегидрогеназы декарбоксилирующей (малик-энзима) с образованием СО2 и пирувата. СО2 поступает в хлоропласты и включается в них в цикл Кальвина, участвуя в синтезе Сахаров.
Таким образом, у растений с фотосинтезом по типу толстянковых много общего с С4-путем фотосинтеза. Однако при САМ-метаболизме фиксация СО2 с образованием малата (ночью) и декарбоксилирование малата с высвобождением СО2 и пирувата (днем) разделены во времени. У С4-растений эти же реакции разграничены в пространстве: первая протекает в хлоропластах мезофилла, вторая — в клетках обкладки. При достаточном количестве воды ряд растений с метаболизмом по типу толстянковых могут вести себя как С3-растения. В свою очередь некоторые растения с С3-путем фотосинтеза при недостатке воды проявляют черты САМ-ме-таболизма.
В растительных клетках, содержащих хлоропласты, помимо С3- и С4-путей фотосинтеза, осуществляется также фотодыхание, т. е. активируемый светом процесс высвобождения СО2 и поглощения О2, который значительно отличается от «темнового» дыхания митохондрий. Так как при этом первичным продуктом является гликолевая кислота, то этот путь получил название гликолатного. У некоторых С3-растений с малой эффективностью фотосинтеза интенсивность фотодыхания может достигать 50% от интенсивности фотосинтеза.
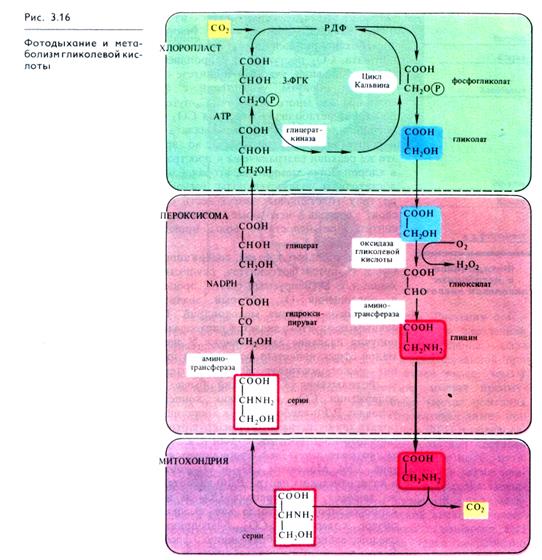
Фотодыхание у С3-растений обычно усиливается при низком содержании СО2 и высоких концентрациях О2. В этих условиях РДФ-карбоксилаза в хлоропластах может функционировать как оксигеназа, катализируя окислительное расщепление рибулозо- 1,5- дифосфата на 3-ФГК и 2-фосфогликолевую кислоту, которая затем дефосфорилируется в гликолевую кислоту (рис. 3.16). Молекулы СО2 и О2 конкурируют между собой в каталитическом центре РДФ-карбоксилазы: при относительно высоких концентрациях СО2 и низких О2 преобладает карбоксилирование, тогда как высокие концентрации О2 и низкое содержание СО2 благоприятствуют окислению, а следовательно, и образованию фосфогликолевой кислоты. В том же направлении действует и повышение температуры.
Фотодыхание осуществляется в результате взаимодействия трех органелл — хлоропластов, пероксисом и митохондрий (рис. 3.16). Гликолат из хлоропласта поступает в пероксисому и там окисляется гликолатоксидазой до глиоксилата. Возникающая перекись водорода устраняется каталазой перокси-сомы. Глиоксилат аминируется, превращаясь в глицин, причем в качестве донора аминогруппы функционирует глутамат.
Глицин транспортируется в митохондрию. Здесь из двух молекул глицина образуется серии и освобождается СО2. Теперь цикл замыкается: серии может снова поступать в пероксисому и там передать свою аминогруппу на пируват. При этом из пирувата возникает аланин, из серина — гидрокси-пируват, который сразу после этого восстанавливается в глицерат. Затем глицерат может снова попасть в хлоропласты и благодаря фосфорилированию включиться в цикл Кальвина.
Последовательность реакций фотодыхания не обязательно образует цикл. Гликолатный путь С3-растений может завершиться в митохондриях. Конечными продуктами в этом случае являются серии и СО2. Освобождение СО2 объясняет, почему нетто-фотосинтез (чистая продуктивность) при интенсивном фотодыхании снижается (рис. 3.16).
У С4-растений СО2, выделяющийся в результате фотодыхания, перехватывается в клетках мезофилла, где из ФЕП и СО2 образуются оксалоацетат и малат. Затем малат
«отдает» свой СО2 хлоропластам обкладки, где функционирует цикл Кальвина. В связи с этим становится понятным высокий нетто-фотосинтез С4-растений.
Однако для чего же тогда нужно фотодыхание? Необходимо вспомнить, что гликолатный путь приводит к синтезу глицина и серина, в пероксисомах происходит восстановление NADP+; имеются косвенные данные о том, что в процессе образования серина может генерироваться и АТР. Показано, что С3-растения, помещенные в атмосферу с низким парциальным давлением О2 и высокой концентрацией СО2, ведут себя подобно С4-растениям, т. е. имеют низкий уровень фотодыхания.
 Из всего сказанного можно сделать вывод, что термин фотодыхание имеет лишь формальный смысл: О2 потребляется, СО2 выделяется, однако в функциональном плане к дыханию этот процесс прямого отношения не имеет.
Из всего сказанного можно сделать вывод, что термин фотодыхание имеет лишь формальный смысл: О2 потребляется, СО2 выделяется, однако в функциональном плане к дыханию этот процесс прямого отношения не имеет.
Регуляция фотосинтеза осуществляется на уровне фотохимически активных мембран, хлоропластов, клеток, тканей, органов и целого организма. Все системы регуляции принимают участие в этом процессе.
Лист как орган фотосинтеза. Основные функции листа зеленого растения — фотосинтез (воздушное питание), транспирация (регулируемое испарение воды) и синтез ряда органических веществ, в том числе некоторых фитогормонов (ауксина, гиббереллинов, абсцизовой кислоты).
Лист, как правило, имеет плоскую форму и дорсовентраль-ное строение. Пластинчатая форма листа обеспечивает наибольшую поверхность на единицу объема ткани, что создает наилучшие условия для воздушного питания.
Важнейшая ткань листа — мезофилл, где осуществляется фотосинтез (рис. 3.17). Покрывающий лист эпидермис, клетки которого, за исключением замыкающих клеток устьиц, не содержат хлоропластов, защищает ткани листа, регулирует газообмен и транспирацию. Система разветвленных проводящих пучков необходима для снабжения тканей листа водой, минеральными и некоторыми органическими веществами и для оттока ассимилятов в другие части растения. Мезофилл обычно дифференцирован на две ткани — палисадную (столбчатую), расположенную под верхним эпидермисом, и губчатую, находящуюся в нижней стороне листа. В палисадном мезофилле клетки вытянуты перпендикулярно поверхности листа и расположены в один или несколько слоев. Клетки губчатого мезофилла связаны друг с другом более рыхло из-за больших межклетников. У большинства растений устьица находятся на нижней стороне листа, обширные межклетники губчатой паренхимы обеспечивают газообмен. Благодаря развитой системе межклетников мезофилл обладает громадной поверхностью, во много раз превышающей наружную поверхность листа.
Палисадная ткань, обращенная к свету, содержит большую часть всех хлоропластов листа и выполняет основную работу по ассимиляции СО2. Число слоев клеток мезофилла в листе в большой степени зависит от интенсивности освещения.
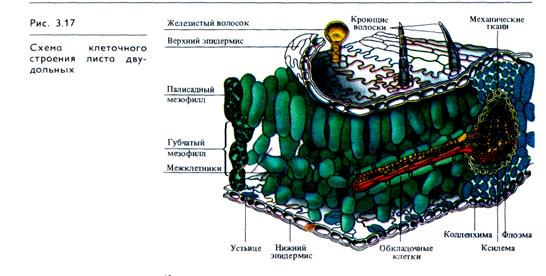
Листья, выросшие на ярком свету, имеют, как правило, более развитый столбчатый мезофилл. У растений засушливых ареалов — ксерофитов — палисадная паренхима часто расположена по обеим сторонам листа, а губчатая сильно редуцирована или совсем отсутствует.
Рассмотрим теперь последовательность процессов, которые происходят в клетках и тканях зеленого листа при переходе от темноты к свету.
Процессы в хлоропластах при переходе к фотосинтезу. При освещении листьев хлоропласты уже через несколько минут начинают уменьшаться в объеме, становясь более плоскими (дисковидными). Тилакоиды и граны сдвигаются и уплотняются. Фотоиндуцируемое сокращение хлоропластов объясняется возникновением трансмембранных протонных градиентов и изменением электрического потенциала мембран хлоропластов. Определенная степень сжатия хлоропласта необходима для эффективной работы электронтранспортной цепи и для ее сопряжения с образованием АТР. Транспорт протонов внутрь тилакоидов приводит к подкислению их внутренней полости до рН 5,0 — 5,5 и одновременному подщелачиванию стромы хлоропласта от рН 7,0 в темноте и до рН 8,0 на свету. Вход ионов Н+ в тилакоиды сопровождается выходом из них в строму ионов Mg2+.
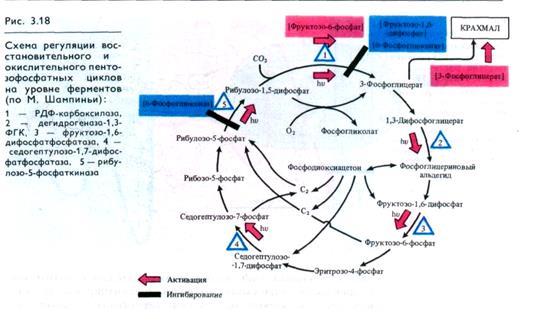 Появление NADPH, АТР, О2, Mg2+ и изменение рН оказывают прямое и опосредованное влияние на реакции фотосинтетического усвоения СО2 в строме. Экспериментально показано, что фиксация СО2 изолированными хлоропластами практически не обнаруживается при рН ниже 7,2, но достигает максимальных значений при рН 8,0. Причина этого заключается в изменении активности ряда ферментов, имеющих оптимум рН в слабощелочной среде: рибулозофосфаткиназы (рН 7,9), дегидрогеназы фосфоглицеринового альдегида (рН 7,8), рибулозо-1,5-дифосфаткарбоксилазы (рН от 7,5 до 8,0), фруктозе дифосфатазы (рН 7,5 — 8,5). Повышение рН стромы при освещении хлоропласта приводит к значительному связыванию СО2 в виде Н2СО3 и накоплению НСО-3, из которого СО2 освобождается с помощью карбоангидразы перед карбоксили-рованием рибулозо- 1,5- дифосфата.
Появление NADPH, АТР, О2, Mg2+ и изменение рН оказывают прямое и опосредованное влияние на реакции фотосинтетического усвоения СО2 в строме. Экспериментально показано, что фиксация СО2 изолированными хлоропластами практически не обнаруживается при рН ниже 7,2, но достигает максимальных значений при рН 8,0. Причина этого заключается в изменении активности ряда ферментов, имеющих оптимум рН в слабощелочной среде: рибулозофосфаткиназы (рН 7,9), дегидрогеназы фосфоглицеринового альдегида (рН 7,8), рибулозо-1,5-дифосфаткарбоксилазы (рН от 7,5 до 8,0), фруктозе дифосфатазы (рН 7,5 — 8,5). Повышение рН стромы при освещении хлоропласта приводит к значительному связыванию СО2 в виде Н2СО3 и накоплению НСО-3, из которого СО2 освобождается с помощью карбоангидразы перед карбоксили-рованием рибулозо- 1,5- дифосфата.
I ATP участвует в фосфорилировании рибулозо 5- фосфата и ФГК, а также в реакциях, связанных с синтезом сахарозы и крахмала. NADPH необходим для восстановления ФГК до ФГА и для образования малата из щавелевоуксусной кислоты. Mg2+ нужен для функциональной активности РДФ- карбокси-лазы, он также принимает участие в синтезе хлорофилла и белков.
 2015-05-26
2015-05-26 2223
2223
