Адсорбцией называется изменение концентрации какого-либо вещества в поверхностном слое по сравнению с объемной фазой, отнесенной к единице поверхности этого слоя. Адсорбция наблюдается на поверхности раздела фаз: твердое вещество- жидкость, твердое вещество- газ, жидкость – жидкость.
адсорбирующего вещества можно использовать уравнение Гиббса, устанавливающее связь между величиной адсорбции Г, концентрацией С и уменьшением поверхностного с ростом концентрации адсорбтива:
Г=- С/RT∙ dG/dс (1)
График Г=f(с) при Т=const (изотерма адсорбции) имеет вид кривой, которая выходит из начала координат и возрастает с увеличением концентрации сначала быстро, а затем всё медленнее и медленнее, так что кривая асимптотически приближается к некоторой прямой, параллельной оси абсцисс:
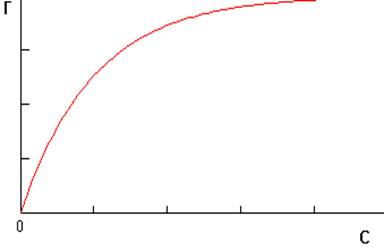
Рис.1
Уравнение Гиббса в принципе применимо ко всем случаям адсорбции; однако на практике оно применимо лишь к системам жидкость-газ, в которых поверхностное натяжение G легко поддается измерению. Когда же дело имеет с практически важной адсорбцией на твердых поверхностях, для которых отсутствуют методы непосредственного определения G, пользуются другими уравнениями, например, уравнением Ленгмюра:
Г=Г∞∙ КС/1+КС (2)
где Г- величина адсорбции;
Г∞- предельное количество адсорбирующего вещества;
С- равновесная концентрация растворенного вещества после адсорбции, моль/л;
к – константа равновесия, равная отношению констант скоростей адсорбции и десорбции.
Некоторые случаи адсорбции на твердых, особенно пористых поверхностях, которые не могут быть описаны ни уравнением Гиббса, ни уравнением Фрейндлиха:
Г=βxсα (3)
где Г- количество вещества в миллимолях, адсорбированного граммом твердого адсорбтива;
С- равновесная концентрация растворенного вещества после адсорбции, моль/л;
β и α – константы, причем α всегда меньше единицы.
Построенная по уравнению (3) кривая Г=f(с) отличается от изотермы Гиббса и Ленгмюра тем, что лишена начального участка и не дает предельного значения адсорбции. Другими словами, уравнение Фрейндлиха справедливо только в интервале средних концентраций.
 2015-05-26
2015-05-26 769
769








