Молярная электропроводность.
Молярная электрическая проводимость раствора – мера электрической проводимости всех ионов, образующихся при диссоциации 1 моль электролита при данной концентрации. Молярная электропроводность – это электрическая проводимость объема раствора V(м3), заключенного между двумя параллельными электродами, с межэлектродным расстоянием 1 м, причем каждый электрод имеет такую площадь, чтобы в этом объеме содержался 1 моль растворенного вещества.
Между молярной и удельной электрическими проводимостями имеется соотношение
l=æV=æ/C, где
l - молярная электрическая проводимость, См·м2/моль; æ – удельная электрическая проводимость, См/м; V – разведение раствора, м3/моль; С – концентрация, моль/м3. Если концентрация раствора выражена в моль/дм3, а æ – в См/см, то это уравнение записывается в виде
l=1000·æ/С.
Электропроводность зависит от:
1. концентрации;
2. температуры;
3. вязкости раствора;
4. диэлектрической проницаемости среды.
Зависимость от концентрации.
а) удельная электрическая проводимость æ=f(С).
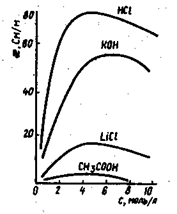 В растворах сильных и слабых электролитов рост æ обусловлен увеличением числа ионов в объеме раствора. В области концентрированных растворов сильных электролитов понижение æ связано с увеличением вязкости растворов. У слабых электролитов снижается степень диссоциации, а, следовательно, и число ионов, переносящих электричество.
В растворах сильных и слабых электролитов рост æ обусловлен увеличением числа ионов в объеме раствора. В области концентрированных растворов сильных электролитов понижение æ связано с увеличением вязкости растворов. У слабых электролитов снижается степень диссоциации, а, следовательно, и число ионов, переносящих электричество.
б) молярная электрическая проводимость l=f(С).
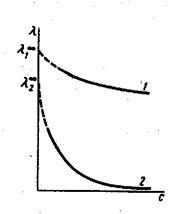 С уменьшением концентрации l увеличивается. Это объясняется тем, что 1) для сильных электролитов с уменьшением концентрации увеличивается расстояние между ионами и уменьшается межионное взаимодействие;
С уменьшением концентрации l увеличивается. Это объясняется тем, что 1) для сильных электролитов с уменьшением концентрации увеличивается расстояние между ионами и уменьшается межионное взаимодействие;
2) для слабых электролитов с уменьшением концентрации увеличивается степень диссоциации a, т.е. увеличивается число ионов.
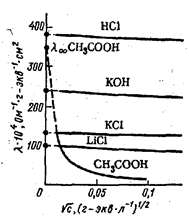
Зависимость молярной электропроводности от концентрации – это тест на силу электролита.
Кольрауш экспериментально установил, что для сильных электролитов существует зависимость
 l=l¥ - А
l=l¥ - А 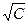 ,
,
где l - молярная электропроводность; l¥ - молярная электропроводность бесконечно разбавленного раствора; А – константа, зависящая от диэлектрической проницаемости e, вязкости растворителя h и температуры А=82,4/(eТ)1/2h. Если выразить зависисмость l от 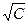 графически, то получим для сильного электролита прямую, а для слабого электролита – кривую. Для сильных электролитов молярная электропроводность при бесконечном разбавлении l¥ обычно находится графической экстраполяцией прямой l=f(
графически, то получим для сильного электролита прямую, а для слабого электролита – кривую. Для сильных электролитов молярная электропроводность при бесконечном разбавлении l¥ обычно находится графической экстраполяцией прямой l=f(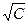 ) к С=0. Для слабых электролитов l¥ находится по закону независимого движения ионов Кольрауша:
) к С=0. Для слабых электролитов l¥ находится по закону независимого движения ионов Кольрауша: 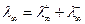 , где
, где 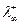 - предельная подвижность катиона,
- предельная подвижность катиона, 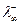 - предельная подвижность аниона. Эти значения можно найти в таблицах справочников.
- предельная подвижность аниона. Эти значения можно найти в таблицах справочников.
В концентрированных растворах электролитов существует два вида торможения ионов: релаксационное и электрофоретическое.
 2015-05-26
2015-05-26 984
984







