Энергия кристаллической решетки представляет собой работу, которую нужно затратить для разрушения решетки, т.е. для разведения составляющих её ионов на бесконечно большое расстояние в вакууме. Энергию кристаллической решетки рассчитывают на моль исследуемого вещества. Для оценки этой энергии воспользуемся модельным методом, который был предложен М. Борном (1920 г.). Рассмотрим два прямо противопо-ложно заряженных иона, составляющих данную кристаллическую решетку, которые имеют абсолю-тные заряды z 1 e 0 z 2 e 0 (e 0 – элементарный заряд) и находятся друг от друга на расстоянии r. Силу электростатического взаимодействия (притяжения) между этими ионами можно определить по закону Кулона:
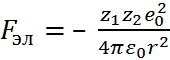 (2.2.1)
(2.2.1)
где, 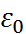 – диэлектрическая постоянная вакуума, равная 0,88542 ∙ 10–11 Ф/м.
– диэлектрическая постоянная вакуума, равная 0,88542 ∙ 10–11 Ф/м.
Один фарадей – это заряд одного моля электронов, равный 96484,5 К л ∙ моль.
Можно предположить, что первый ион закреплен в положении r = 0, а сила F эл действует на второй ион в направлении первого иона (рис. 2.1). Поскольку направление силы F эл противоположно направлению оси r, то F эл < 0. Одновременно на ионы действует сила отталкивания F от, обусловленная взаимодействием электронных оболочек и не позволяющая ионам бесконечно близко подойти друг к другу.
Предположим, что сила F от также приложена ко второму иону. Поскольку направление этой силы совпадает с направлением оси r, то F от 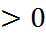 . Силу F от можно представить в виде
. Силу F от можно представить в виде
F от = 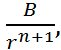 (2.2.2) где В и n – константы, причем n
(2.2.2) где В и n – константы, причем n 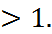
Таким образом, суммарная сила взаимодействия ионов равна
F = F эл + F от = – 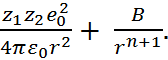 (2.2.3)
(2.2.3)
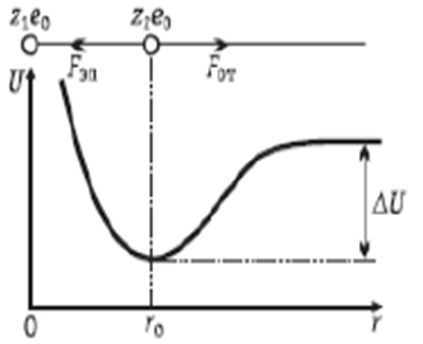
Рис. 2.1 К расчету энергии взаимодейст-вия двух ионов
По определению, F = – 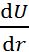 , где U – потен-циальная энергия системы. Поэтому интегрируя величину F от равновесного расстояния (r) между ионами в кристаллической решётке до r
, где U – потен-циальная энергия системы. Поэтому интегрируя величину F от равновесного расстояния (r) между ионами в кристаллической решётке до r 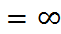 , находим изменение потенциальной энергии
, находим изменение потенциальной энергии 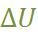 , соответствующее удалению двух рассматриваемых ионов на бесконечно большое расстояние (см. рис. 2.1)
, соответствующее удалению двух рассматриваемых ионов на бесконечно большое расстояние (см. рис. 2.1)
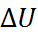 = –
= – 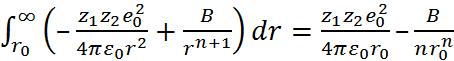 . (2.2.4)
. (2.2.4)
Константу В можно рассчитать по уравнению
(2.2.3), так как в равновесном состоянии, когда r= 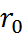 , F =0. Следовательно,
, F =0. Следовательно,
B = 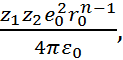
а уравнение (2.2.4) можно переписать в виде
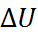 =
= 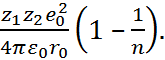 (2.2.5)
(2.2.5)
Формула (2.2.5) получена для одной пары ионов. Чтобы перейти к энергии кристал-лической решётки, расчитываемой на моль вещества, необходимо умножить 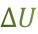 на число Авогадро
на число Авогадро 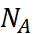 и учесть взаимодействие между всеми ионами, которое определяется их взаим-ным расположением в объёме решётки. Последняя поправка эквивалентна введенею ещё одного множителя A – так называемой конста-нты Маделунга, которая зависит от типа криста-ллической решетки. Например, для хлорида натрия
и учесть взаимодействие между всеми ионами, которое определяется их взаим-ным расположением в объёме решётки. Последняя поправка эквивалентна введенею ещё одного множителя A – так называемой конста-нты Маделунга, которая зависит от типа криста-ллической решетки. Например, для хлорида натрия
А = 1,7476.
Таким образом, модель Борна, связывающая свободную энергию кристаллической решётки с потенциальной энергией взаимодействия образу-ющих её ионов, приводит к формуле 1)
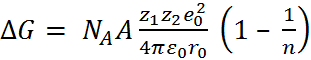 (2.2.6)
(2.2.6)
_________
1) В конденсированных системах энергия элект-ростатического взаимодействия существенно бо-льше, чем энтропийный фактор T 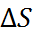 и работа расширения p
и работа расширения p 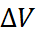 , поэтому
, поэтому 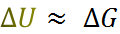
Рентгеноструктурный анализ позволяет уста-новить геометрию кристаллов и определить параметры А и 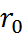 . Константа n обычно рассчитывается из данных по сжимаемости кристаллов. Для NaCl n =7,5; для других солей значение n колеблется от 5 до 12.
. Константа n обычно рассчитывается из данных по сжимаемости кристаллов. Для NaCl n =7,5; для других солей значение n колеблется от 5 до 12.
Расчет по формуле (2.2.6) показывает, что для хлорида натрия энергия кристаллической решетки составляет
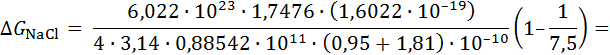
=7,624 ∙ 1 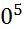 Дж /моль = 762 кДж/моль.
Дж /моль = 762 кДж/моль.
Столь же значительные величины получаются и для других солей.
Для оценки точности формулы (2.2.6) представляет интерес сопоставить 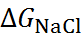 с
с
изменением энтальпии в ходе разрушения крис-таллической решетки хлорида натрия 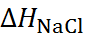 . Величину
. Величину 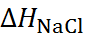 можно определить при помощи следующего термодинамического цикла:
можно определить при помощи следующего термодинамического цикла:
 NaC
NaC 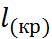
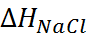 N
N 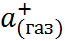 + С
+ С 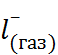

 +
+ 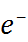
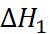 –
– 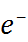
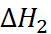
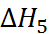 N
N  + С
+ С 
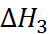
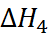
N 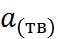 + ½ С
+ ½ С 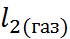
_____________________
Значение 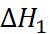 в первом приближении можно приравнять потенциалу ионизации натрия, взято-му с обратным знаком. Изменение
в первом приближении можно приравнять потенциалу ионизации натрия, взято-му с обратным знаком. Изменение 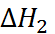 приб-лиженно определяется сродством к электрону атома хлора. Величина
приб-лиженно определяется сродством к электрону атома хлора. Величина 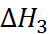 соответствует тепло-вому эффекту при конденсации газообразного натрия, а
соответствует тепло-вому эффекту при конденсации газообразного натрия, а 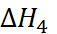 – тепловому эффекту рекомби-нации атомов хлора. Наконец,
– тепловому эффекту рекомби-нации атомов хлора. Наконец, 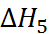 равно тепловому эффекту при сжигании металличе-ского натрия в атмосфере газообразного хлора. Экспериментально было найдено, что
равно тепловому эффекту при сжигании металличе-ского натрия в атмосфере газообразного хлора. Экспериментально было найдено, что 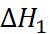 = –496,
= –496, 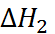 = 365,
= 365, 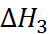 = – 109,
= – 109, 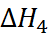 = –121 и
= –121 и 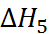 = –411 кДж/моль. Поскольку в замкнутом термодина-мическом цикле по закону Гесса
= –411 кДж/моль. Поскольку в замкнутом термодина-мическом цикле по закону Гесса 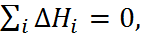 то
то
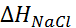 = –(
= –(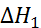 +
+ 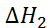 +
+ 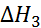 +
+ 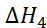 +
+ 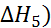 = 772 кДж/моль.
= 772 кДж/моль.
Учитывая данные по теплоёмкости хлорида натрия, можно оценить произведение T 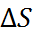 , которое при 25
, которое при 25 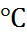 составляет приблизительно 15 кДж/моль. Таким образом, для энергии крис-таллической решётки NaCl получаем
составляет приблизительно 15 кДж/моль. Таким образом, для энергии крис-таллической решётки NaCl получаем 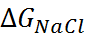 = 757 кДж/моль, что хорошо согласуется с величиной, рассчитанной по формуле (2.2.6).
= 757 кДж/моль, что хорошо согласуется с величиной, рассчитанной по формуле (2.2.6).
В таблице 2.1 представлены данные по изме-нению энтальпии при разрушении кристалли-ческих решеток ряда галогенидов щелочных металлов.
Таблица 2.1. 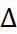 H кристаллических решеток галогенидов щелочных металлов при 25
H кристаллических решеток галогенидов щелочных металлов при 25 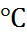
| Катион | 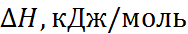 | |||
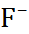 | C 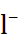 | 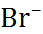 | 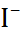 | |
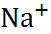 | – | |||
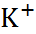 | ||||
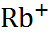 | – | |||
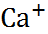 | – | – |
Итак, образование ионов при разрушении кристаллической решётки требует затраты очень большой энергии. Если бы эта энергия не компенсировались энергией сольватации, то степень диссоциации практически равнялась бы нулю. Константа диссоциации NaCl в водном растворе при этом составила бы
K = 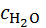 exp
exp 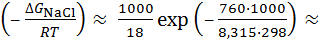
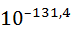 моль/л,
моль/л,
И, следовательно, согласно формуле (1.2.4), степень диссоциации для 0,01 М раствора была бы равна
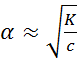
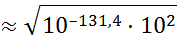
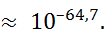
Этот результат показывает, что возражения критиков теории Аррениуса, игнорировавшей ион-дипольное взаимодействие, были вполне обоснованными.
 2015-05-26
2015-05-26 11262
11262
