Эмпирические сравнительные характеристи-ки сольватирующей способности растворителей возникли на основе представлений о льюисовских кислотах и основаниях. В отличие от протонной теории кислот и оснований Брёнстеда (см. раздел 1.4), теория В. Льюиса (1923 г.) оперирует сродством к электронам, принадлежащим атому или атомной группе и образующим координационную связь. Льюисовская кислота – это акцептор таких электронов (пар электронов), а льюисовское основание – донор. Определения оснований по Брёнстеду и Льюису охватывает один и тот же круг соединений, а круг льюисовских кислот значительно шире – он включает наряду с протонными кислотами также соединения, не содержащие атомов водорода.
Кислотно-основные свойства характеризуют акцепторными и донорными числами соответ-твенно. Все характеристики такого рода предпо-лагают выбор некоего стандарта или двух стан-дартов, ограничивающих условную шкалу. Обычно донорно-акцепторные свойства корре-лируют с полярностью молекул, поэтому стан-дартами становятся практически неполярный растворитель и, наоборот, растворитель с высо-кой полярностью. В первом приближении все однотипные характеристики донорно-акцепто-рных свойств коррелируют между собой, а также с энергиями сольватации отдельных ионов.
Донорные и акцепторные числа часто опре-деляют на основе сольватохромизма (смещение полосы поглощения в УФ-видимой области в результате избирательной сольватации нуклео-фильного или электрофильного фрагмента) или по величине химических сдвигов в спектрах ЯМР.
В научной литературе используется большое число разных шкал донорно-акцепторных чисел. В некоторых случаях донорное число (DN) – это выраженная в ккал/моль энтальпия реакции, нап-ример, такой (донорное число Гуттмана, 1966 г.); S + SbC 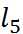
 S:SbC
S:SbC 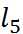 , где S обозначает молекулу растворителя. В ходе этой реакции пентахлорид сурьмы, обладающий акцепторными свойствами, принимает два электрона и превращается в соединение гексакоординированной сурьмы.
, где S обозначает молекулу растворителя. В ходе этой реакции пентахлорид сурьмы, обладающий акцепторными свойствами, принимает два электрона и превращается в соединение гексакоординированной сурьмы.
Акцепторное число (AN) Гуттмана оперирует с реакцией взаимодействия молекул раствори-теля триэтилфосфиноксидом (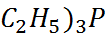 =O, кото-рый служит донором электронов. Благодаря донорно-акцепторному взаимодействию типа ↷
=O, кото-рый служит донором электронов. Благодаря донорно-акцепторному взаимодействию типа ↷
(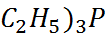 =O
=O 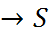
в спектре ЯМР наблюдается химический сдвиг сигнала 31Р. Акцепторное число растворителя принимают пропорциональным величине этого сдвига 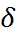 31Р. При нормировке полагают, что
31Р. При нормировке полагают, что 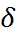 31Р
31Р
для взаимодействия (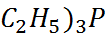 O + SbC
O + SbC 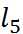 в гексане
в гексане
соответствует акцепторному числу, равному 0, а для той же реакции в дихлорэтане акцепторное число равно 100.
Донорные и акцепторные числа Гуттмана для восьми растворителей, широко используемых в электрохимических системах, приведены в табл. 2.7. Там же представлены значения константы кислотности по Димросу–Рейхардту (1963 г.), ко-торые принято обозначать 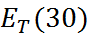 . Величина
. Величина 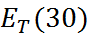 – это энергия взаимодействия бетаи-на(30)
– это энергия взаимодействия бетаи-на(30) 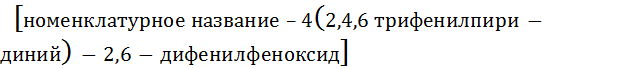 с данным раствори-телем. Для нахождения
с данным раствори-телем. Для нахождения  снимают спектры поглощения в соответствующем растворе бета-ина(30) и фиксируют линию спектра, отвеча-ющую максимальному поглощению. Энергия кванта hv в соответствующей фотохимической реакции
снимают спектры поглощения в соответствующем растворе бета-ина(30) и фиксируют линию спектра, отвеча-ющую максимальному поглощению. Энергия кванта hv в соответствующей фотохимической реакции
 | |||
 | |||


















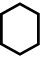

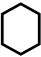

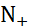 hv N
hv N







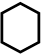









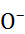
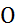
пересчитанная в ккал/моль (1ккал = 4,19 кДж), и дает величину 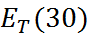 . Зарегистрированные экспериментально смещения полосы довольно велики – максимумы для разных растворителей лежат в интервале 453-810 нм.
. Зарегистрированные экспериментально смещения полосы довольно велики – максимумы для разных растворителей лежат в интервале 453-810 нм.
Аналогичный (основанный на явлении сольвато-хромизма) метод определения донорного числа 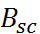 использует фотохимическую реакцию с учас-тием квадратного комплекса Cu(II)N,N,
использует фотохимическую реакцию с учас-тием квадратного комплекса Cu(II)N,N, 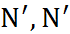 - те-траметилэтилендиаминацетоацетоната.
- те-траметилэтилендиаминацетоацетоната.
Параметр кислотности 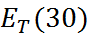 , как и акцеп-торное число, характеризует акцепторные свойс-тва растворителя. Поэтому между величинами
, как и акцеп-торное число, характеризует акцепторные свойс-тва растворителя. Поэтому между величинами 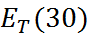 и AN имеется корреляция,
и AN имеется корреляция,
Таблица 2.7. Параметры, характеризующие донорные и акцепторные свойства ряда растворителей
| Растворитель | DN | AN | 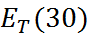 |
| Вода Метанол Диметилформамид Ацетонитрил Диметилсульфоксид Ацетон Формамид Гексаметилфосфортриамид | 18,0 19,0 26,6 14,1 29,8 17,0 24,0 38,8 | 54,8 41,3 16,0 18,9 19,3 12,5 39,3 10,6 | 63,1 55,5 43,8 45,6 45,1 42,2 56,6 40,9 |
которую для приведенных в табл. 2.7 раствори-телей можно записать в виде линейного соотношения 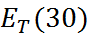 = 35,8 + 0,5 AN. Средние отклонение значений
= 35,8 + 0,5 AN. Средние отклонение значений 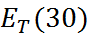 , рассчитанных по этой формуле, от опытных величин, приведе-нных в таблице, составляет всего 1,2
, рассчитанных по этой формуле, от опытных величин, приведе-нных в таблице, составляет всего 1,2 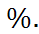 Аналогичные корреляции отмечены и для других эмпирических характеристик растворителей, например
Аналогичные корреляции отмечены и для других эмпирических характеристик растворителей, например 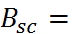 525,2 + 2,89 DN.
525,2 + 2,89 DN.
Анализ такого рода корреляций между разными акцепторными или донорными числами растворителей позволил собрать данные для более чем двухсот органических растворителей. Выявлены многочисленные отклонения от линейных корреляций в основном обусловлен-ные взаимодействием молекул растворителя с несколькими разными фрагментами тестируемых молекул. В частности, установлено, что линей-ные корреляционные соотношения, связываю-щие те или иные пары донорных (акцепторных) чисел, в общем случае различны для рядов протонных и апротонных растворителей. Причи-ной различий является в первую очередь возни-кновение водородных связей между молекулами протонных растворителей и различными фрагме-нтами сольватируемых молекул. Например, в бетаине(30) фотоперенос заряда на самом деле частично делокализован, т. е. под действием ква-нта света электрон лишь частично переносится на атом азота. Одновременно возникают неболь-шие локальные отрицательные заряды на фено-льных фрагментах, что приводит к образованию водородных связей на периферии молекулы. Этот зависящий от природы растворителя фактор искажает полосу поглощения по-разному для разных сольватируемых молекул, используемых в независимых методах определения донорных и акцепторных чисел.
В общем случае растворители со сложным строением молекул обладают как донорными, так и акцепторными свойствами (т. е. содержат донорные и акцепторные фрагменты). Поэтому получила распространение универсальная эмпирическая шкала, в которой характерная частота v смещается при изменении природы растворителя относительно реперной частоты 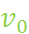 на величину а α+ b β
на величину а α+ b β 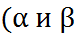 – условные шкалы кислотности и основности соответственно, а и b – эмпирические коэффициенты). Универсальная шкала (так называемая шкала
– условные шкалы кислотности и основности соответственно, а и b – эмпирические коэффициенты). Универсальная шкала (так называемая шкала 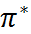 ) иногда исполь- зуется в усовершенствованном виде – с допол-нительной поправкой на поляризуемость моле-кул растворителя, что, однако, требует введения ещё одного эмпирического коэффициента.
) иногда исполь- зуется в усовершенствованном виде – с допол-нительной поправкой на поляризуемость моле-кул растворителя, что, однако, требует введения ещё одного эмпирического коэффициента.
 2015-05-26
2015-05-26 1448
1448








