В качестве растворителей в электрохимии, как правило, используются полярные жидкости либо смеси полярных и неполярных жидкостей. Критерием полярностей является способность обеспечивать полную либо частичную диссоци-ацию ионофоров. Согласно модели Борна, это становится возможно в тех случаях, когда ста-тическая диэлектрическая проницаемость 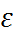 сос-тавляет не менее 10–15. Наряду с
сос-тавляет не менее 10–15. Наряду с 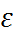 имеются также другие важные характеристики раствори-телей – плотность, давление насыщенного пара, характеристические температуры (
имеются также другие важные характеристики раствори-телей – плотность, давление насыщенного пара, характеристические температуры (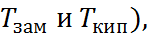 термические свойства, вязкость, сжимаемость, поверхностное натяжение и термодинамическая устойчивость (часто говорят об «окне» потенциалов устойчивости – интервале, ограниченном потенциалами окисления и восстановления молекул растворителя).
термические свойства, вязкость, сжимаемость, поверхностное натяжение и термодинамическая устойчивость (часто говорят об «окне» потенциалов устойчивости – интервале, ограниченном потенциалами окисления и восстановления молекул растворителя).
Традиционная химическая классификация растворителей предполагает их разделение на две большие группы – протонные (вода, спирты, простые амиды и т. д., т. е. соединения, содержащие группы –ОН и –NH) и апротонные (табл. 2.8). Наиболее существенное различие двух этих типов растворителей состоит в том, что только в протонных растворителях возможно образование водородных связей между свободными и связанными в сольватные оболочки молекулами. Водородные связи могут образовываться также с анионами электролита или нуклеофильными фрагментами молекул растворенного вещества. Именно водородные связи приводят к ассоциации молекул в протонных средах. В апротонных жидкостях процессы ассоциации (обычно димеризации) являются следствием электростатических ди-поль-дипольных взаимодействий.
Во многих отношениях уникальным, а также наиболее доступным полярным растворителем является вода (табл. 2.9). Малые (в 2-4 раза меньше, чем для других растворителей) размеры молекул воды и, соответственно, малый мольный объем определяют высокую концентрацию 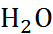 в чистой воде (55,5 М) и возможность обеспечения высокой мольной доли растворителя в разба-вленных растворах электролитов. По этой причи-не, а также из-за достаточно высокой диэле-ктрической проницаемости воды менее выраже-нными оказываются отклонения водных раст-воров от идеальности при заданной концен-трации.
в чистой воде (55,5 М) и возможность обеспечения высокой мольной доли растворителя в разба-вленных растворах электролитов. По этой причи-не, а также из-за достаточно высокой диэле-ктрической проницаемости воды менее выраже-нными оказываются отклонения водных раст-воров от идеальности при заданной концен-трации.
Хотя молекула воды может быть эффективно представлена как диполь, дифрактометрические данные однозначно указывают на её квадру-польный характер (рис. 2.5). Симметрия молеку-лы воды (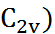 предполагает наличие квадрупо-льного момента.
предполагает наличие квадрупо-льного момента.
Таблица 2.9. Важнейшие свойства воды
| Свойство | 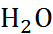 | 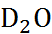 |
| Молярная масса | 18,015 | 20,027 |
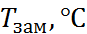 | 3,8 | |
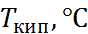 | 101,4 | |
Статическая диэлектрическая про- ницаемость (25 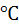 ) ) | 78,4 | |
| Дипольный момент свободной мо- лекулы, Д | 1,85 | 1,94 |
Время релаксации (25 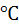 ), пс ), пс | 8.32 | 1,02 |
Поляризуемость, Кл· 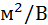 | 1,62·1 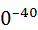 | 1,20·1 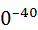 |
Пекаровский фактор (25 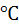 ) ) | 0,549 |
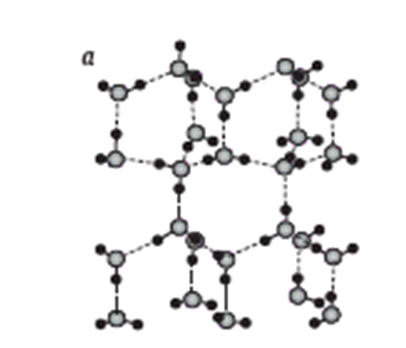
Кластеризация воды представляет собой процесс формирования тетраэдров (рис. 2.6, а) с одной молекулой воды в центре. Представления о тетраэдрической координации были впервые сформулированы Дж. Берналом и Р.Фаулером (1933 г.). К этому заключению достаточно надежно приводят данные дифрактометрии и колебательной спектроскопии. Тетраэдры стаби-лизированы водородными связями и относите-льно слабо коррелируют между собой. Именно такой характер кластеризации определяет наряду с диполь-дипольными взаимодействиями элект-ростатической природы высокую диэлектри-ческую проницаемость воды. При растворении неполярных веществ молекулы воды образуют вокруг них сложные многогранники, стабили-зируемые водородными связями. Типичны, в час-тности, пентагональные додекаэдры (рис. 2.6. б), в объеме которых находится полость размером около 0,5 нм.
Свободные


 орбитали
орбитали


 Атом –
Атом – 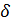 –2
–2 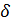




 кислорода ⟺ –
кислорода ⟺ – 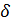 ⟺
⟺

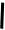
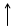


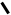
 +
+ 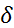 +
+ 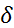
 +
+ 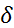 +
+ 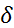
Рис. 2.5. Схематическое представление молекулы воды как эффективного квадруполя
Установлена также возможность кластеризации таких многогранников (рис.2.6, в), которые формируют стабильные кристаллогидраты в жидком состоянии.
Разрушение водородных связей при встраивании воды в сольватные оболочки ионов

















































 в
в
 Рис. 2.6. Тетраэдрическая (а)
Рис. 2.6. Тетраэдрическая (а) 





 и додекаэдрическая (б)
и додекаэдрическая (б) 









 структуры воды и схемати
структуры воды и схемати 
 че-
че-



 ское изображение
ское изображение 

 кластпризо-
кластпризо-


 ванных многогранников в
ванных многогранников в 



 жид-
жид-









 жидком кристаллогидрате (в).
жидком кристаллогидрате (в).
 |  |  |








(особенно катионов), затрагивающие также вторичные и даже более удаленные от иона гидратные оболочки, обусловливают снижение эффективной диэлектрической проницаемости водных растворов электролитов с ростом их концентрации. Предполагая, что вода в непо-средственном контакте с ионом находится в состоянии диэлектрического насыщения, т. е. практически полностью теряет способность ориентироваться по отношению к внешнему электрическому полю, и имеет при этом ди-электрическую проницаемость около 6, для диэлектрической проницаемости некоторых ра-створов 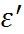 можно получить следующую зависи-мость от концентрации раствора c (в моль/л):
можно получить следующую зависи-мость от концентрации раствора c (в моль/л):
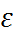 =80
=80 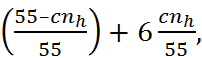 (2.7.1)
(2.7.1)
где 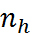 – число молекул воды в окружении иона (число гидратации).
– число молекул воды в окружении иона (число гидратации).
Таким образом, в принципе на основе измерения концентрационных зависимостей диэ-лектрической проницаемости растворов можно проводить определение чисел сольватации ионов. Однако в широком концентрационном интервале линейность  -зависимости наруша-ется.
-зависимости наруша-ется.
Следует однако иметь в виду, что при образовании ионных пар (в принципе предста-вляющих собой диполи) возможны изменения диэлектрической проницаемости противополо-жного типа по сравнению с описываемыми уравнениями (2.7.1) – увеличение  с ростом концентрации. Влияние ионов разной природы на величину снижения диэлектрической проницаемости достаточно специфично и связано с зависящим от химической природы и заряда иона строением сольватных оболочек.
с ростом концентрации. Влияние ионов разной природы на величину снижения диэлектрической проницаемости достаточно специфично и связано с зависящим от химической природы и заряда иона строением сольватных оболочек.
Измерения диэлектрических характеристик воды и других растворителей показывают, что величина 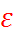 снижается с увеличением частоты используемого в эксперименте переменного поля. Частотная зависимость дает информацию о динамическом поведении молекул как в чистом растворителе, так и в растворах. Причиной конечной скорости релаксации является необходимость осуществить переориентацию дипольных частиц, чтобы энергия системы достигла минимума, – этот процесс требует времени от 1 до 100 нс.
снижается с увеличением частоты используемого в эксперименте переменного поля. Частотная зависимость дает информацию о динамическом поведении молекул как в чистом растворителе, так и в растворах. Причиной конечной скорости релаксации является необходимость осуществить переориентацию дипольных частиц, чтобы энергия системы достигла минимума, – этот процесс требует времени от 1 до 100 нс.
Для воды была обнаружена необычная часто-тная зависимость 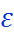 , отвечающая существованию быстрой и медленной подсистем. Формально можно, соответственно, выделить два характер-ных времени релаксации. Обычно полагают, что большее из них (около 8 пс) отвечает релаксации кластеров в целом, а меньшее (около 1пс) – собственно релаксации водородных связей. Не исключено, что динамическая картина на самом деле значительно сложнее и требует усоверше-нствования моделей, применяемых для анализа диэлектрических спектров.
, отвечающая существованию быстрой и медленной подсистем. Формально можно, соответственно, выделить два характер-ных времени релаксации. Обычно полагают, что большее из них (около 8 пс) отвечает релаксации кластеров в целом, а меньшее (около 1пс) – собственно релаксации водородных связей. Не исключено, что динамическая картина на самом деле значительно сложнее и требует усоверше-нствования моделей, применяемых для анализа диэлектрических спектров.
Предельно низкое значение оптической диэ-лектрической проницаемости 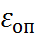 (оно соответ-ствует только электронной поляризуемости) для воды составляет при 25
(оно соответ-ствует только электронной поляризуемости) для воды составляет при 25  1,78 и существенно отличается от измеряемой при частотах ИК-диапазона величины, равной 4,49. Если рассма-тривать быструю и медленную подсистемы как совершенно независимые друг от друга и
1,78 и существенно отличается от измеряемой при частотах ИК-диапазона величины, равной 4,49. Если рассма-тривать быструю и медленную подсистемы как совершенно независимые друг от друга и 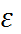 = 78 считать статической диэлектрической проницае-мостью для медленной подсистемы, то анало-гичная статическая составляющая для быстрой подсистемы оказывается близкой к 6. С учетом этих обстоятельств в сольватационных моделях с пространственной дисперсией диэлектрической проницаемости в качестве характерного значе-ния
= 78 считать статической диэлектрической проницае-мостью для медленной подсистемы, то анало-гичная статическая составляющая для быстрой подсистемы оказывается близкой к 6. С учетом этих обстоятельств в сольватационных моделях с пространственной дисперсией диэлектрической проницаемости в качестве характерного значе-ния 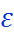 в структурированных областях (вблизи заряженных частиц и поверхностей) выбирают модельный параметр
в структурированных областях (вблизи заряженных частиц и поверхностей) выбирают модельный параметр 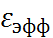 , равный 5 или 6.
, равный 5 или 6.
Эмпирические характеристики сольватирую-щей способности растворителей (например, до-норные и акцепторные числа) коррелируют с микроскопическими свойствами, в первую оче-редь с неравномерностью зарядовых распреде-лений в молекулах растворителей, которую можно охарактеризовать величинами электриче-ских моментов разного порядка. Наличие у многоатомных частиц тех или иных составля-ющих дипольного момента 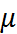 , квадрупольного θ и т. д. однозначно определяется симметрией молекул. Величины дипольных моментов
, квадрупольного θ и т. д. однозначно определяется симметрией молекул. Величины дипольных моментов 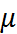 традиционно приводятся в литературе во внесистемных единицах – дебаях (Д);
традиционно приводятся в литературе во внесистемных единицах – дебаях (Д);
1 Д = 3.336 · 1 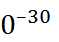 Кл · моль. Квадрупольные мо-менты имеют размерность Кл ·
Кл · моль. Квадрупольные мо-менты имеют размерность Кл · 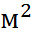 ; порядок их величин, как правило, 1
; порядок их величин, как правило, 1 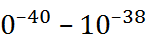 Кл ·
Кл · 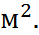
Величины дипольных и квадрупольных мо-ментов для многих молекул могут быть рассчитаны с высокой точностью квантово-химическими методами. Однако возможны различия распределений заряда в свободных молекулах в среде; например, при наличии водородных связей в кристаллосольватах поля-рность молекул увеличивается, что может приводить к завышению значений 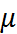 на 50–60%.
на 50–60%.
Эффективные (усредненные по всем электронным, колебательным и вращательным состояниям молекул) дипольные моменты и одновременно поляризуемости молекул α в отсутствие химических и диполь-дипольных взаимодействий (в том числе водородных связей) можно получить путем измерений диэлектрической проницаемости при разных температурах, применяя уравнение Дебая
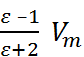 =
= 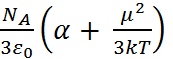 (2.7.2)
(2.7.2)
(где 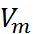 – мольный объем, k – постоянный Боль-цмана) и проводя соответствующий регрес-сионный анализ. При частотах, превышающих вращательные частоты диполей, в правой части уравнения (2.7.2) преобладает вклад первого слагаемого. Следовательно, подставляя в него
– мольный объем, k – постоянный Боль-цмана) и проводя соответствующий регрес-сионный анализ. При частотах, превышающих вращательные частоты диполей, в правой части уравнения (2.7.2) преобладает вклад первого слагаемого. Следовательно, подставляя в него 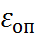 вместо
вместо 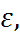 можно провести независимое оп-ределение
можно провести независимое оп-ределение 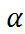 при фиксированных температурах.
при фиксированных температурах.
Чтобы снизить вклады диполь-дипольных и химических взаимодействий в определяемые ве-личины 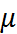 , измерения диэлектрической проница-емости проводят в разбавленных растворах полярных веществ в неполярных средах (бензол, диоксан, циклогексан). При этом получаются, по-видимому, значения, заниженные примерно на 10% (по сравнению, например, с опреде-ленными для молекул в газовой фазе спектро-скопически). Эти различия можно учесть введе-нием в уравнение Дебая различных поправок (Л.Онзагер, Дж. Кирквуд), учитывающих частот-ную дисперсию диэлектрической проница-емости. Такие поправки одновременно позволя-ют получить и более точные выражения для динамических квазимикроскопических характе-ристик жидкостей – дебаевских времен релак-сации
, измерения диэлектрической проница-емости проводят в разбавленных растворах полярных веществ в неполярных средах (бензол, диоксан, циклогексан). При этом получаются, по-видимому, значения, заниженные примерно на 10% (по сравнению, например, с опреде-ленными для молекул в газовой фазе спектро-скопически). Эти различия можно учесть введе-нием в уравнение Дебая различных поправок (Л.Онзагер, Дж. Кирквуд), учитывающих частот-ную дисперсию диэлектрической проница-емости. Такие поправки одновременно позволя-ют получить и более точные выражения для динамических квазимикроскопических характе-ристик жидкостей – дебаевских времен релак-сации 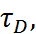 относящихся к более и менее быстрым подсистемам. Однако измерения диэлектриче-ской проницаемости в принципе не позволяет независимо определить составляющие полного дипольного момента.
относящихся к более и менее быстрым подсистемам. Однако измерения диэлектриче-ской проницаемости в принципе не позволяет независимо определить составляющие полного дипольного момента.
При рассмотрении явлений сольватации ис-пользуются наряду со статическими диэлектри-ческими проницаемостями также значения так называемого пекаровского фактора 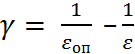 (см. табл. 2.8, 2.9) В качестве релаксационной ха-рактеристики применяется иногда динамическая вязкость η, связанная в первом приближении с дебаевским временем релаксации
(см. табл. 2.8, 2.9) В качестве релаксационной ха-рактеристики применяется иногда динамическая вязкость η, связанная в первом приближении с дебаевским временем релаксации 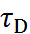 соотноше-нием
соотноше-нием
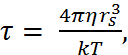 (2.7.3)
(2.7.3)
где 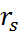 – радиус молекулы растворителя.
– радиус молекулы растворителя.
Используя жидкие растворители при норма-льных условиях, варьировать такие важные хара-ктеристики, как диэлектрическая проницаемость и время релаксации, можно в пределах примерно одного порядка. Поскольку термодинамические свойства растворов электролитов чрезвычайно чувствительны к 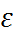 , а кинетика процессов в раст-ворах – к
, а кинетика процессов в раст-ворах – к  соответс- твующих величин в рядах растворителей обес-печивает б
соответс- твующих величин в рядах растворителей обес-печивает б  льшие возможности эксперименталь-ной проверки теории.
льшие возможности эксперименталь-ной проверки теории.
Многие растворители (и особенно раствори-тели, склонные к ассоциации) обнаруживают сложное релаксационное поведение в их диэлек-трических спектрах появляется несколько специ-фичных участков в разных частотных диапазо-нах. Эти участки отвечают характерным време-нам различных процессов, сопровождающихся изменением дипольных моментов участвующих в них ассоциатов. Растворители с таким поведе-нием часто называют недебаевскими. Для них соотношение (2.7.3) оказывается неприменимым, а выбор того или иного времени релаксации – зависимым от природы исследуемых динамиче-ских явлений в растворах и на межфазных границах.
Попытки установления границ примени-мости различных физических теорий стимули-руют исследования необычных смешанных
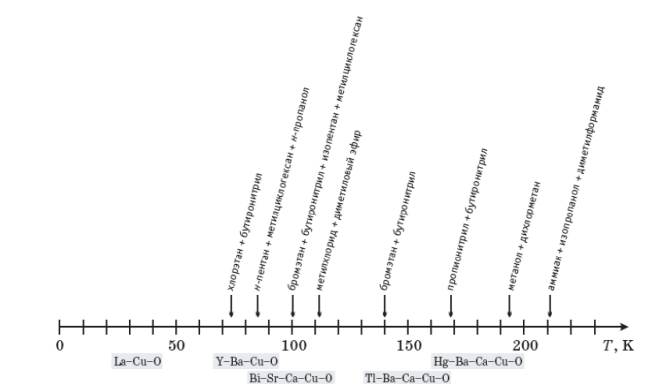
Рис. 2.7. Низкотемпературные квазижидкие системы,
Разработанные в связи с задачами электрохимии купратных сверхпроводников  (A = Ba, Sr, Ca; B = La, Y, Bi, Tl, Hg)
(A = Ba, Sr, Ca; B = La, Y, Bi, Tl, Hg)
растворителей и растворов в различных экстре-мальных условиях.
Можно выделить три уровня конструиро-вания «экстремальных» ион-дипольных систем.
Во-первых, расширить интервал свойств ра-створителей или изменить свойства растворителя при постоянстве его состава можно путем варьирования его температуры и давления в обычной (субкритической) области.
Во-вторых, расширить температурный интер-вал в сторону более низких значений удаётся путем использования специально подобранных смесей растворителей (рис. 2.7), обеспечиваю-щих сохранение квазижидкого состояния вплоть до температур, близких к температуре жидкого азота (77 К). Разработки таких смесей стимули-ровались в 1980-90-е годы развитием высокоте-мпературных оксидных сверхпроводников – в частности, задачей проведения измерений на электродах в сверхпроводящем состоянии в жид-ких растворах. Интервалы температур перехода в сверхпроводящее состояние для нескольких кла-ссов сверхпроводящих купратов разного катион-фного состава показаны на рис. 2.7.
Третьим, быстро развивающимся направле-нием является использование растворителей в сверхкритическом состоянии. Такое состояние (рис. 2.8) достигается при сжатии газа (пара) под давлением выше критического (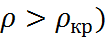 при температурах выше критической (T
при температурах выше критической (T 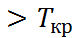 ). Вбли-зи критической точки (кр.т.) происходят резкие изменения плотности и вязкости, а также полярных свойств жидкости. Это связывают с кластеризацией молекул жидкости в агрегаты большого (по сравнению с молекулярным) раз-мера. При переходе в устойчивое сверхкри-тическое состояние (T/
). Вбли-зи критической точки (кр.т.) происходят резкие изменения плотности и вязкости, а также полярных свойств жидкости. Это связывают с кластеризацией молекул жидкости в агрегаты большого (по сравнению с молекулярным) раз-мера. При переходе в устойчивое сверхкри-тическое состояние (T/ 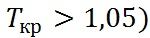 кластеры раз-рушаются, и свойства жидкости снова резко меняются. Некоторые сверхкритические жидкос-ти (скж), находящие практическое применение, перечислены в табл. 2.10.
кластеры раз-рушаются, и свойства жидкости снова резко меняются. Некоторые сверхкритические жидкос-ти (скж), находящие практическое применение, перечислены в табл. 2.10.
Аномалии свойств жидкостей в сверхкрити-ческом состоянии определяют целый ряд особых свойств на их основе и возможность интенсифи-кации многих процессов гомогенного и гетероге-нного катализа. Уменьшение полярности упро-щает теоретическое описание жидкостей и раст-воров на их основе. Вода при переходе в сверхкритическое состояние, как и другие жидкости, обнаруживает снижение дипольного момента. При этом почти на три порядка возрастает ионное произведение воды (при дальнейшем росте T /  оно, однако, снижается на несколько порядков по сравнению с обычным для субкритической воды).
оно, однако, снижается на несколько порядков по сравнению с обычным для субкритической воды).
Растворимости большинства веществ в свер-хкритических жидкостях достаточно высоки и возрастают с увеличением давления. Темпера-турные зависимости, как и в обычных жидкостях могут демонстрировать как рост, так и снижение предельной концентрации с температурой. Ос-новные тенденции для соотношения раствори-мости полярных и неполярных веществ опреде-ляют снижением полярности растворителя при переходе в сверхкритическое состояние.
Таблица 2.10. Сведения о критических точках некоторых раство-
 2015-05-26
2015-05-26 2863
2863








