Вследствие электронейтральности молекулы соли общий заряд входящих в неё катионов всегда равен по абсолютной величине общему заряду анионов. Поэтому, как следует из уравнения (2.4.2), реальная и химическая сольватация соли совпадают. Таким образом, суммируя величины 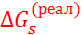 для катионов и анионов, можно получить свободные энергии сольватации соли, а затем сопоставить их с соответствующими теплотами сольватации. Такое сопоставление для фторидов щелочных металлов в воде приведено в табл. 2.5.
для катионов и анионов, можно получить свободные энергии сольватации соли, а затем сопоставить их с соответствующими теплотами сольватации. Такое сопоставление для фторидов щелочных металлов в воде приведено в табл. 2.5.
Разность 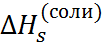 –
– 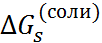 = T
= T 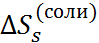 поз-воляет рассчитать энтропии сольватации
поз-воляет рассчитать энтропии сольватации 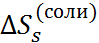 (см. табл. 2.5). Энтропии гидротации солей отрицательны. Отсюда следует, что при введении ионов структура воды становится более упорядоченной из-за ориентирующего действия ионов на ближайшие к иону диполи воды. Энтропии сольватации отдельных ионов экспериментально определить невозможно. Чтобы разделить суммарные величины
(см. табл. 2.5). Энтропии гидротации солей отрицательны. Отсюда следует, что при введении ионов структура воды становится более упорядоченной из-за ориентирующего действия ионов на ближайшие к иону диполи воды. Энтропии сольватации отдельных ионов экспериментально определить невозможно. Чтобы разделить суммарные величины 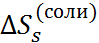 на составляющие их энтропии
на составляющие их энтропии 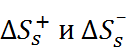 , пользуются модельными допущениями. В частности, в рамках модели Борна, как следует из уравнений (2.3.5) и (2.3.7), энтропия сольватации отдельного иона
, пользуются модельными допущениями. В частности, в рамках модели Борна, как следует из уравнений (2.3.5) и (2.3.7), энтропия сольватации отдельного иона
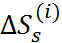 =
= 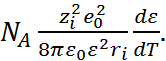 (2.5.1)
(2.5.1)
Поскольку диэлектрическая постоянная воды уменьшается с ростом температуры 1), то в качес-твенном согласии с опытом формула (2.5.1) при-водит к отрицательным значениям 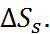
1) В широком интервале температур справедливо следующее полиномиальное описание: 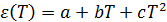 , где a = 249,21, b = –0,79069, c =0,00073.
, где a = 249,21, b = –0,79069, c =0,00073.
Таблица 2.5. Энтальпия, свободные энергии Гиббса и энтропия гидратации фторидов щелочных металлов при 25 
| Соль | – 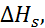 кДж/моль кДж/моль | – 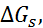 кДж/моль кДж/моль | – 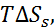 кДж/моль кДж/моль | – 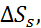 кДж/моль кДж/моль |
| LiF | ||||
| NaF | ||||
| KF | ||||
| RbF | ||||
| CsF |
Таблица 2.6. Рассчитанные по Борну и экспериментальные (в скобках) величины парциальных энтропий гидратации ионов при 25  , Дж/(К·моль).
, Дж/(К·моль).
| Катион | 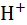 | 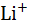 | 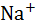 | 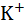 | 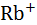 | 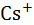 |
– 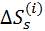 | (153) | (164) | (133) | (96) | (87) | (81) |
| Анион | 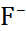 | 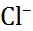 | 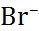 | 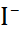 |
– 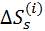 | (115) | (53) | (37) | (14) |
Однако рассчитанные на основе модели Борна значения 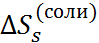 оказываются в несколько раз меньше экспериментальных (по абсолютной величине). В табл. 2.6 экпериментальные вели-чины (они даны в скобках) соответствуют шкале, прокалиброванной по масс-спектрометрическим данным для иона
оказываются в несколько раз меньше экспериментальных (по абсолютной величине). В табл. 2.6 экпериментальные вели-чины (они даны в скобках) соответствуют шкале, прокалиброванной по масс-спектрометрическим данным для иона 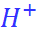 так, как это было описано выше в разделе 2.4.
так, как это было описано выше в разделе 2.4.
Между диполями растворителя и ионами раствора возникают, наряду с чисто электроста-тическим, и другие типы ион-дипольного взаи-модействия, имеющие более сложную природу (они специально рассмотрены в разделе 2.8). Совокупность таких взаимодействий (наиболее типичными из которых являются водородные связи), а также существенных для некоторых систем диполь-дипольных взаимодействий часто описывают в терминах донорно-акцепторных свойств растворителей.
 2015-05-26
2015-05-26 2056
2056








