Решение 1. Используя закон разбавления, находим степень диссоциации NH4OH.
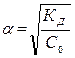 ;
; 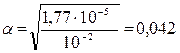
Находим концентрацию диссоциировавших частиц.
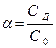 ;
; 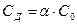 ;
; 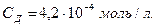
Согласно уравнению реакции С (ОН−) = СД = 4,2.10-4 моль/л.
Решение 2. Концентрацию ионов ОН− также можно вычислить, пользуясь соотношением 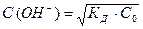 (5);
(5);
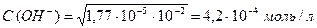 .
.
В случае наличия в молекуле двух или более связей, которые ионизируются с последующей диссоциацией, процесс распада на ионы протекает ступенчато и для каждой ступени определяется значение константы диссоциации, например,
I. Н2СО3 ↔ Н+ + НСО3–, КД/ = 4,5.10–7;
II. НСО3− ↔ Н+ + СО32−, КД// = 4,8.10–11
или I. Pb(OH)2 ↔ PbOH+ + OH−, КД/ = 9,55.10–4
II. PbOH+ ↔ Pb2+ + OH−, КД// = 3,0.10–8.
При этом константа диссоциации для каждой последующей стадии всегда меньше, чем для предыдущей, т.к. увеличение заряда диссоциирующей частицы затрудняет выход из неё иона с противоположным зарядом.
Сильные многоосновные кислоты и многокислотные щёлочи диссоциируют по I ступени как сильные электролиты, а по II ступени – как электролиты средней силы.
 2015-05-26
2015-05-26 1279
1279








