Вода является очень слабым электролитом. Электролитическая диссоциация воды выражается следующим уравнением:
Н2О <=> Н+ + ОН-
Это обратимый процесс. Константа диссоциации воды запишется:
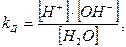
умножая левую и правую части выражения на [H2O],
получим 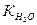 = [Н+]∙[ОН-],
= [Н+]∙[ОН-],
где 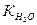 = Кд∙[H2O] и называется ионным произведением воды Это уравнение показывает, что при постоянной температуре произведение концентрации ионов водорода и гидроксид-ионов есть величина постоянная.
= Кд∙[H2O] и называется ионным произведением воды Это уравнение показывает, что при постоянной температуре произведение концентрации ионов водорода и гидроксид-ионов есть величина постоянная.
При 220С [Н+]∙[ОН-] = 10-14 мол/л. В воде [Н+] = [ОН-] = 10-7 мол/л.
В зависимости от концентрации ионов водорода различают нейтральную, кислую и основную (щелочную) среду (растворы).
Растворы, в которых [Н+] = 10-7 мол/л – нейтральные растворы. В нейтральных растворах присутствуют ионы H+ и OH-. Концентрации ионов равны 10-7 мол/л.
Растворы, в которых [Н+] > 10-7 мол/л – кислые растворы. В кислых растворах присутствуют ионы H+ и OH-. Однако концентрация ионов H+ (например, 10-6, 10-5 и т.д.) выше концентрации OH- (например, 10-8 , 10-9 )
Растворы, в которых [Н+] < 10-7 мол/л – щелочные растворы. В щелочных растворах присутствуют ионы H+ и OH-. Однако концентрация ионов H+ (например 10-8, 10-9 и т.д.) ниже концентрации OH-.
|
|
|
В 0,01 М растворе HCl при 250С [Н+] = 0,01 = 10-2 мол/л, т.к. HCl – сильный электролит и a = 1. При этом концентрация гидроксид ионов: [ОН-]= 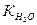 / [Н+] = 10-14 / 10-2 = 10-12 мол/л.
/ [Н+] = 10-14 / 10-2 = 10-12 мол/л.
Для характеристики среды пользуются не значением концентрации ионов водорода [Н+], а величиной водородного показателя (рН):
рН = -lg[Н+]
рН = 7 – нейтральная среда,
рН < 7 – кислая среда,
рН > 7 – щелочная среда.
Для 0,01 М раствора HCl [H+] = 10-2 мол/л, рН = - lg 10-2 = 2,
для 0,01 М раствора NaOH рН = - lg 10-12 = 12.
 2015-05-26
2015-05-26 1033
1033








