Расчет pH и pOH растворов сильных кислот.
Вода является слабым амфотерным электролитом. В чистой воде содержатся молекулы Н2О, а также ионы Н+ и ОН-, образующиеся при диссоциации воды:
Н2О↔Н+ + ОН-
Произведение концентраций ионов Н+ и ОН- называется ионным произведением воды Кв. Для воды и разбавленных растворов электролитов Кв=cont и при 298 К равно 10-14:
Кв= [H+]∙[OH-]= 10-14 (17)
Cильные кислоты в растворе диссоциируют полностью:
HCl→ H+ + Cl-, NH+=1
Согласно теории электролитической диссоциации ионы Н+ являются носителями кислотных свойств раствора. Концентрацию Н+-ионов можно вычислить:
[H+]= c(B)∙α∙NH+ (18)
c(B) – молярная концентрация кислоты, моль/л;
α – степень диссоциации;
NH+- число Н+-ионов, образующихся при диссоциации 1 молекулы кислоты.
Кислотность среды водного раствора сильной кислоты характеризуют водородным показателем рН:
pH= -lg[H+] (19)
Водородный и гидроксильный показатели взаимосвязаны:
рН + рОН =14 (20)
Пример 11. ОпределитеpOH 0,1н раствора Н2SO4, степень электролитической диссоциации которой равна 90%.
|
|
|
Решение. Н2SO4 – сильный электролит, процесс диссоциации описывается уравнением: H2SO4 = 2H+ + SO42-; NH+ = 2;
1. Определим молярную концентрацию кислоты:
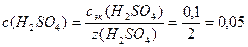 моль/л;
моль/л;
2. Определим концентрацию Н+ - ионов по формуле (18): 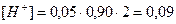 моль/л;
моль/л;
3.Определим рН раствора кислоты:
рН = -lg 0,09 = 1,05;
4. pOH = 14 – pH = 14 – 1,05= 12,95
Пример 12. Определите концентрацию гидроксид-ионов 5%-ного раствора HCl, степень электролитической диссоциации HCl равна 80%, плотность раствора 1,03 г/мл.
Решение. HCl – сильный электролит, уравнение диссоциации: HCl =H+ + Cl-; NH+ = 1.
1. Определим молярную концентрацию HCl:
Примем m(р-ра)=100г, тогда m(HCl)= 5г,
Vр-ра= m(р-ра)/ρ(р-ра)= 100/1,03=97,08 мл;
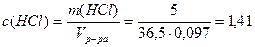 моль/л
моль/л
2. Определим концентрацию Н+ - ионов в растворе по формуле (18):
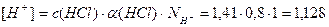 моль/л;
моль/л;
3. Определим концентрацию ОН– - ионов по ионному произведению воды по формуле (17):
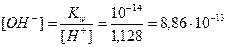 моль/л
моль/л
Пример 13. В 3л раствора содержится 0,015 моль HCl и 0,075 моль H2SO4, a(HCl)=1, a(H2SO4)=1. Определите pOH раствора.
Решение. Раствор содержит две сильные кислоты, уравнения их диссоциации:
HCl = H+ + Cl-; NH+= 1; H2SO4 = 2H+ + SO42- ; NH+ = 2;
1. Определим концентрацию H+ - ионов, обусловленных содержанием HCl:
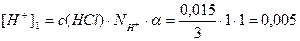 моль/л;
моль/л;
- Определим концентрацию H+ -ионов, обусловленных
содержанием H2SO4:
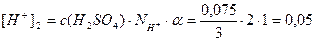 моль/л;
моль/л;
- Общая концентрация H+ - ионов равна:
[H+] = [H+]1 + [H+]2 = 0,005 + 0,05 = 0,055 моль/л;
- Определим концентрацию ОH– - ионов по формуле (17):
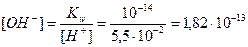 моль/л;
моль/л;
- Определим рОН раствора:
pOH = -lg[OH-] = 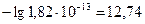
Пример 14. Рассчитайте pH раствора, полученного при смешивании 50 мл 0,1М HCl, 15мл 0,1M NaOH и 935мл H2O.
Решение. При смешивании щелочи и кислоты в растворе происходит реакция нейтрализации:
NaOH + HCl = NaCl + H2O
Реакция среды раствора будет определяться избытком
кислоты или щелочи, оставшейся после реакции.
1. Определим nэк(HCl):
|
|
|
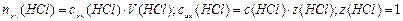
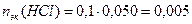 моль-эк;
моль-эк;
2. Определим nэк(NaOH):
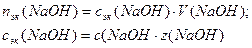
z(NaOH) = 1
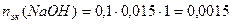 моль-эк;
моль-эк;
3. Взаимодействующие в ходе реакции вещества подчиняются закону эквивалентов: nэк(HCl) = nэк(NaOH). Следовательно, после реакции в растворе останется избыток HCl в количестве:
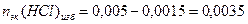 моль-эк;
моль-эк;
4. Определим концентрацию Н+ - ионов:
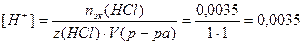 моль/л;
моль/л;
V(р-ра) = 50 + 15 + 935 = 1000 мл = 1л;
5. pH = -lg [H+]= -lg 0,0035 = 2,46
 2015-05-26
2015-05-26 3075
3075








