Сильные основания в растворе диссоциируют полностью:
KOH→ K+ + OH-,NOH-=1
Ионы ОН- являются носителями щелочных свойств раствора. Концентрацию ОН- - ионов можно рассчитать:
[OH-]= c(B)∙α∙NOH- (21)
c(B) – молярная концентрация основания, моль/л;
α – степень диссоциации;
NOH- - число ионов ОН-, образующихся при диссоциации 1 молекулы основания.
Щелочную реакцию среды водного раствора основания характеризуют гидроксильным показателем рОН:
рОН= -lg[OH-] (22)
Так как водородный и гидроксильный показатели взаимосвязаны, можно определить рН раствора основания:
рН= 14 – рОН (23)
Пример 15. Определите концентрации ионов Н+, ОН- и рН 0,3н раствора NaOH, степень электролитической диссоциации NaOH равна 80%.
Решение. NaOH – сильное основание, уравнение диссоциации: NaOH ®Na+ + OH–, NOH– = 1.
1. с(NaOH) = сэк(NaOH) = 0,3 моль/л, так как z(NaOH)=1.
2. Определим концентрацию ОН– - ионов по формуле (21):
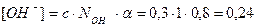 моль/л;
моль/л;
3. Определим концентрацию Н+ - ионов по ионному произведению воды по формуле (17):
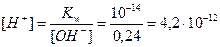 моль/л;
моль/л;
4. 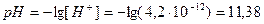
Пример 16. Определите pH раствора, в 1л которого содержится 0,0051г гидроксид-ионов.
 2015-05-26
2015-05-26 10125
10125
