1. Рассчитаем молярную концентрацию OH– - ионов:
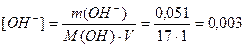 моль/л;
моль/л;
2. Рассчитаем концентрацию H+ - ионов по формуле (17):
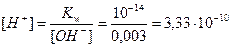 моль/л;
моль/л;
3. 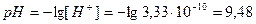 ;
;
Пример 17. 0,01М раствор КОН разбавили в тысячу раз. Определите рН раствора.
Решение. Пусть объем раствора КОН равен 1л. c(КОН)=0,01моль/л; n(KOH)=0,01моль. При разбавлении раствора объем увеличивается в 1000 раз и равен 1000л. Изменяется и концентрация раствора:
1. Определим молярную концентрацию КОН:
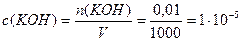 моль/л;
моль/л;
2. Определим концентрацию ОН– - ионов в растворе:
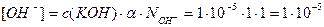 моль/л;
моль/л;
a(КОН) = 1; КOH ® К+ + OH–, NOH– = 1;
3. Определим концентрацию Н+ - ионов:
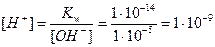 моль/л;
моль/л;
4.рН= -lg [H+] = 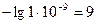 .
.
Пример 18. Вычислите рН 1%-ного раствора Ba(OH)2,если α(Ba(OH)2)=100%, плотность раствора равна 1,02 г/мл.
Решение. Ba(OH)2 – сильный электролит, уравнение диссоциации: Ba(OH)2= Ba2+ + SO42-; NOH- = 2;
1. Определим молярную концентрацию Ва(ОН)2:
Примем m(р-ра)=100г, тогда
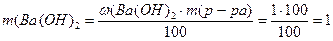 г;
г;
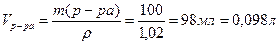 ;
;
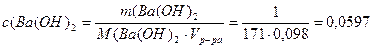 моль/л;
моль/л;
2. Определим концентрацию OH– - ионов в растворе по формуле (21):
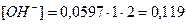 моль/л;
моль/л;
3. Определим концентрацию Н+ - ионов по формуле (17):
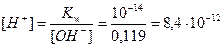 моль/л;
моль/л;
4. 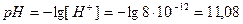
 2015-05-26
2015-05-26 7798
7798








