В растворах слабых электролитов (кислот, оснований) процесс диссоциации протекает неполностью, обратимо и характеризуется константой диссоциации. Так, для процесса диссоциации слабой кислоты HCN
HCN↔ H+ + CN-
константа диссоциации Кдис равна:
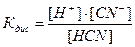 (24)
(24)
[H+],[CN-],[HCN] – равновесные концентрации катионов, анионов и молекул кислоты в растворе, моль/л.
Кдис и степень диссоциации (α) разбавленных растворов слабых электролитов связаны соотношением (закон разбавления Оствальда):
Кдис= с∙α2 (25)
Концентрация Н+- ионов в растворе слабой кислоты определяется по формуле (18):
[H+]= c(B)∙α∙NH+, где
c(B) – молярная концентрация кислоты, моль/л;
α – степень диссоциации, определяемая с учетом Кдис по формуле (25).
NH+- число ионов Н+, образующихся при диссоциации кислоты по первой ступени.
Кислотность среды водного раствора кислоты характеризуют водородным показателем рН, который рассчитывают по формуле (19):
pH= -lg[H+]
Концентрация ОН- ионов в растворах слабых оснований определяется по формуле (21):
[OH-]= c(B)∙α∙NOH-, где
c(B) – молярная концентрация основания, моль/л;
α – степень диссоциации слабого основания, определяемая с учетом Кдис по формуле (25).
NOH- - число ионов ОН-, образующихся при диссоциации основания по первой ступени.
Щелочную реакцию среды водного раствора основания характеризуют гидроксильным показателем рОН, определяемым по формуле (22):
рОН= -lg[OH-]
Пример 19. В 3л раствора содержится 12г СН3СООН.
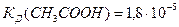 . Определите α(СН3СООН), концентрацию [Н+] и pH раствора.
. Определите α(СН3СООН), концентрацию [Н+] и pH раствора.
Решение. СН3СООН – слабый электролит. При ее диссоциации устанавливается равновесие:
СН3СООН 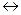 Н+ + СН3СОО-, NH+=1.
Н+ + СН3СОО-, NH+=1.
1. Определим с(CH3COOH):
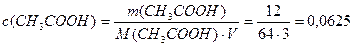 моль/л;
моль/л;
2.Определим α:
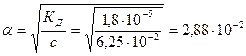 ;
;
3. Определим концентрацию [H+] по формуле (18):
[H+] = с∙α∙NH+ = 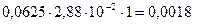 моль/л;
моль/л;
4. рН = -lg[H+] = 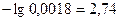

Пример 20. Определите концентрацию гидроксид-ионов и рОН в 0,1М растворе Н2СО3, КдI(H2CO3)= 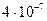
Решение. Н2СО3 – слабая многоосновная кислота. Концентрация ионов Н+ в растворе определяется процессом диссоциации кислоты по первой ступени:
I ступень: Н2СО3 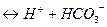 ; NH+=1;
; NH+=1;
1. Определим a:
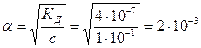
2. Определим [H+]
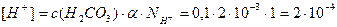 моль/л
моль/л
3. Определим концентрацию [OH–] по формуле (17):
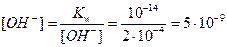 моль/л;
моль/л;
4. 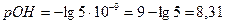
Пример 22. Определите α(NH4OH), концентрацию [H+], pH и pOH 0,01М раствора NH4OH, КД(NH4OH)=1,77 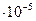 .
.
Решение. NH4OH – слабый электролит, уравнение диссоциации: 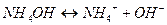 ; NOH_ =1.
; NOH_ =1.
1. Рассчитаем a:
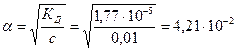 ;
;
2. Рассчитаем концентрацию [OH-]:
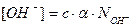
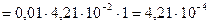 моль/л;
моль/л;
3. Рассчитаем концентрацию [H+] по формуле (17):
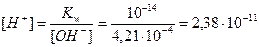 моль/л;
моль/л;
4. 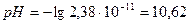 ;
;
5. 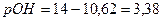 .
.
 2015-05-26
2015-05-26 13665
13665
