Задача 1. Чему равна молярная концентрация частиц в растворе, содержащим 0,11 г CaCl2 в 200 мл раствора?
Решение.
CaCl2 D Ca+2 + 2 Cl-
молярная концентрация CaCl2
C М = 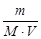 =
= 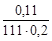 = 5×10-3 моль/л,
= 5×10-3 моль/л,
так как CaCl2 – соль (сильный электролит), а концентрация раствора мала, примем a = 1 (100 %).
Тогда
[CaCl2]расп. на ионы = [CaCl2]общей = 5×10-3 моль/л;
[CaCl2]недис. = 0 моль/л.
Из уравнения электролитической диссоциации следует, что
[Ca+2] = [CaCl2]расп. на ионы = 5×10-3 моль/л;
[C1-] = 2[CaCl2]расп. на ионы =2×5×10-3 = 10-2 моль/л.
Ответ. В растворе присутствуют ионы Ca+2 и C1-, молекулы CaCl2 – отсутствуют. [Ca+2] =5×10-3, [C1-] =10-2 моль/л.
Задача 2. Определить концентрации [Н+], [CН3СОО-] и [CН3СООН] в 0,1 M растворе CН3СООН, если a =1,34 %.
Решение. CН3СООН D Н+ + CН3СОО-]. Ионы CН3СОО- и Н+ образуются из молекул CН3СООН, участвующих в электролитической диссоциации. Из уравнения следует, что
[CН3СОО-] = [Н+]= [CН3СООН]расп. на ионы.
По определению a = С расп. на ионы / C общее кол-во, следовательно,
[CН3СОО-] расп. на ионы = [CН3СООН]общ.× a = 0,1× 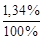 = 1,34 × 10-3 моль/л, отсюда [Н+]= [CН3СОО-] = 1,34× 10-3 моль/л.
= 1,34 × 10-3 моль/л, отсюда [Н+]= [CН3СОО-] = 1,34× 10-3 моль/л.
 2015-05-26
2015-05-26 363
363








