Системы «растворитель-растворенное вещество»

 гомогенные микрогетерогенные гетерогенные
гомогенные микрогетерогенные гетерогенные

 10-10 10-9 10-8 10-7 ,м(размер)
10-10 10-9 10-8 10-7 ,м(размер)

 истинные коллоидные суспензии, эмульсии
истинные коллоидные суспензии, эмульсии
растворы механические смеси
В зависимости от агрегатного состояния:
 | |||
 |


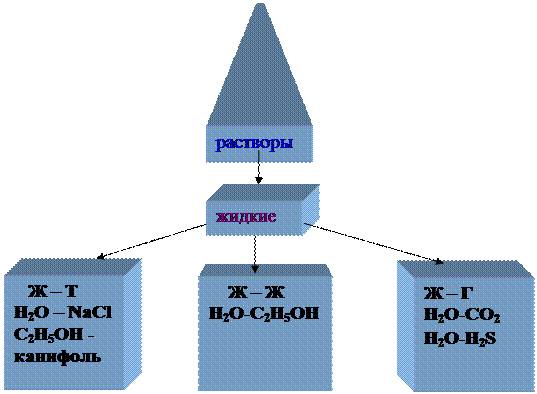
Растворитель (условно)- компонент раствора, концентрация которого выше, чем у других и который не меняет своего фазового состояния при образовании раствора


 В зависимости от природы растворителя
В зависимости от природы растворителя
 | |||
 | |||
Способы выражения концентрации растворов.

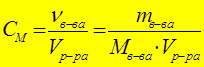 [моль/л, моль/дм3, моль/м3]
[моль/л, моль/дм3, моль/м3]
 2.
2.
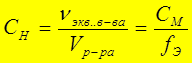 [моль/л, моль/дм3, моль/м3]
[моль/л, моль/дм3, моль/м3]
Пример:
CМ (Н2SО4) = 2 моль/л
Э (Н2SО4) = 1/2 Н2SО4Þ f (Н2SО4) = ½
СН = 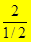 = 4 моль/л
= 4 моль/л

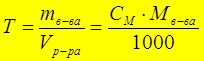 [г/мл, г/см3]
[г/мл, г/см3]
4.Массовая доля вещества, w:

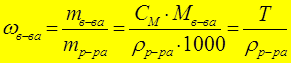 (доли или ´100%)
(доли или ´100%)
r - плотность раствора [г /мл, г/см3]
Растворение - D Gрастворения < 0 Þ самопроизвольный, обратимый процесс.
растворение

 А(к)
А(к)  А(р-р)
А(р-р)
кристаллизация
Насыщенный раствор - в данных условиях дальнейшее самопроизвольное растворение невозможно: D Gрастворения = 0, Jрастворения = Jвыделения.
Ненасыщенный раствор - самопроизвольное растворение вещества еще возможно:
D Gрастворения < 0, Jрастворения > Jвыделения.
Пересыщенный раствор – содержание растворенного вещества больше, чем в насыщенном растворе – неустойчивое состояние.

Растворимость зависит от:
· природы вещества и растворителя,
· давления газа над раствором (если растворяемое вещество газ),
·  от температуры: с температуры растворимость
от температуры: с температуры растворимость
 а) большинства твердых веществ,
а) большинства твердых веществ,
 б) газообразных веществ
б) газообразных веществ
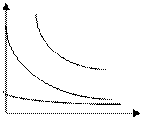 | 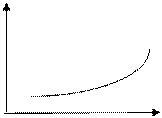 | ||
Ср Cp
CO2
O2 N2
N2
t,0C давление

Растворение - физико-химический процесс.
Ранее – физическая теория образования растворов: механическое диспергирование за счет сил диффузии.
Д.И.Менделеев – физико-химическая теория растворов (гидратная (сольватная) теория растворов).
: взаимодействие растворенного вещества и растворителя
Растворение NaClк в Н2О:
 |  | ||||||||||||
 | |||||||||||||
 |  | ||||||||||||
 | |||||||||||||
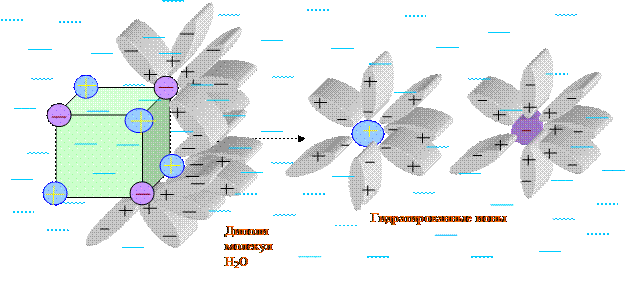 |
Три стадии процесса растворения:
1) процесс ионизации -разрушение связей:
 NaClк Na+(г) + Cl-(г) ; D Нион > 0; D Sион > 0
NaClк Na+(г) + Cl-(г) ; D Нион > 0; D Sион > 0
 2) процесс сольватации (гидратации)- взаимодействие растворителя с растворяющимся веществом с образованием - сольватов (гидратов): N Na+(г) + aq Na+ ×aq (р-р)
2) процесс сольватации (гидратации)- взаимодействие растворителя с растворяющимся веществом с образованием - сольватов (гидратов): N Na+(г) + aq Na+ ×aq (р-р)
 Cl-(г) + aq Cl- ×aq (р-р)
Cl-(г) + aq Cl- ×aq (р-р)
D Нсольв < 0; D Sсольв < 0
3) распределение (диффузия) по объему сольватов (гидратов):
D Ндифф > 0, D Sдифф > 0 – (величины существенно меньше 1 и 2 ст.)
D Н Р = D Н ион + D Н сольв + D Н дифф;
D S Р = D S ион + D S сольв + D S дифф;
D Н0298 NaCl = 335кДж Þ D Нион - доминирует
D S0298 NaCl = 142 кДж/К Þ большое значение - хорошая растворимость
D G0298раств= -8,8 кДж/моль NaCl Þ
 т.к. D Н р > 0 Þ с Т Þ раст-ть увеличивается.
т.к. D Н р > 0 Þ с Т Þ раст-ть увеличивается.
Растворимость LiFк Û Li+(р-р) +F-(р-р)
D Н0298 LiF > 0 - D Нион - доминирует
D S0298 LiF = -33 кДж/К Þ DG0298раств > 0 Þ
LiF -малорастворимая соль
· eсли в H2O растворяются г или ж Þ
D Н ион < D Н сольв Þ D Н р < 0.
· Если растворяются к Þ
D Н ион > D Н сольв Þ D Н р > 0

Cвойства растворов зависят от:
1) числа растворенных частиц (концентрации);
2) энергии взаимодействия молекул растворенного вещества друг с другом;
3) энергии взаимодействия молекул растворенного вещества и растворителя.
Если п.2,3 – малы – раствор идеальный Þ его свойства зависят только от концентрации
(разбавленные растворы неэлектролитов – сахар в воде)


 C концентрации раствора Þ отклонения от законов идеальных растворов из-за взаимодействиями между частицами раствора.
C концентрации раствора Þ отклонения от законов идеальных растворов из-за взаимодействиями между частицами раствора.
Вместо концентрации (с) - активность (а).

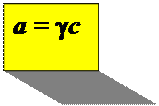
g - коэффициент активности, учитывает все виды взаимодействия частиц в растворе.
g - вычисляют по экспериментальным данным
(температурам кипения, замерзания и др.)
g - безразмерная величина.



 Электролитическая диссоциация:
Электролитическая диссоциация:
(впервые Сванте Аррениус – 1886г)
 NaClк + H2O Na+× aq + Cl-× aq
NaClк + H2O Na+× aq + Cl-× aq
гидратированные ионы
 NaClк H2O Na+ + Cl- DНдисс> 0 –эндотерм.пр.
NaClк H2O Na+ + Cl- DНдисс> 0 –эндотерм.пр.
 Электролиты:
Электролиты:
 степень диссоциации a:
степень диссоциации a:
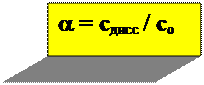
со- исходная концентрация электролита
a- зависит от:
1) природы растворенного вещества:
a( СН3СООН) < a (НСl)
2) природы растворителя: 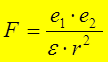 Þ
Þ

 чем e Þ F Þ легче рвется связь под действием полярных молекул растворителя.
чем e Þ F Þ легче рвется связь под действием полярных молекул растворителя.
 e (Н2О) = 81
e (Н2О) = 81
 3) температуры: с Т Þ a
3) температуры: с Т Þ a
 4) концентрации раствора: с концентрацииÞ a
4) концентрации раствора: с концентрацииÞ a
5) введения одноименного иона:
СН3СООН Û СН3СОО- + Н+
 СН3СООNH4 СН3СОО- + NH4+
СН3СООNH4 СН3СОО- + NH4+
 равновесие смещается влево, т.е. a.
равновесие смещается влево, т.е. a.
a < 3% - слабые электролиты – плохо распадаются на ионы;
3% < a < 30% - средние электролиты;
a > 30% - сильные электролиты – практически нацело распадаются на ионы.

Процесс диссоциации - обратим Диссоциация слабой кислоты: НА Û Н+ + А-

g = 1 (взаимодействие слабое) Þ с =g × а =а
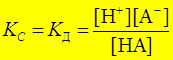 ; [H+] – равновесная концентрация
; [H+] – равновесная концентрация
Диссоциации слабого основания: RОН Û R+ + ОН-
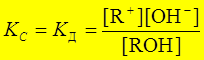
Диссоциация комплексного иона:
[Cu(NH3)4]2+ Û Cu2+ + 4NH3
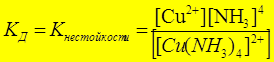
КД зависит от:
· природы диссоциирующего вещества и растворителя;
· температуры.

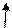 С Т Þ КД, т.к. DНдисс> 0.
С Т Þ КД, т.к. DНдисс> 0.
КД - не зависит от концентрации раствора
К 25д - таблица
КД < 10-10 –очень слабые электролиты
КД = (10-5 – 10-9) – слабые электролиты
КД = (10-2-10-4) – средней силы электролиты
КД > 10-1 – сильные электролиты

Диссоциация муравьиной кислоты:
НСООН Û НСОО- + Н+.
со - исходная концентрация кислоты
a - степень диссоциации,
| НСООН | НСОО- | Н+ | |
| Сисход | со | ||
| DС | aсо | aсо | aсо |
| Сравн | со - aсо | aсо | aсо |
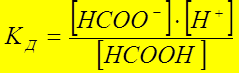
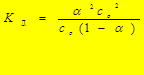
 2015-05-26
2015-05-26 344
344







