Рассчитать рН 0,05 М раствора НСN.
НСN Û Н+ + СN- - слабая кислота с о = 0,05 моль/л
К Д= 7,9×10-10 (из таблицы)
a = 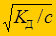 =
= 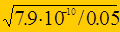 = 1,26×10-4.
= 1,26×10-4.
сH + = a со = 1,26×10-4×0,05 = 6,3×10-6
рН = ‑lg с H+ = - lg 6,3×10-6 = 5,18.
Задача
Рассчитать рН 0,05 М раствора NаОН.
Решение
NаОН ® Nа+ + ОН- - сильное основание
с: 0,05 0,05 0,05 моль/л
I = 1/2(0,05×12 + 0,05×12) = 0,05.
gОН- = 0,85 (по таблице)
а ОН- = gОН- ×с OH- = 0,85×0,05 = 0,043
рН = 14 + lg а ОН - = 14 - 1,37 = 12,63.
| Индикатор | Область рH | Окраска | |
| В кислом растворе | В щелоч растворе | ||
| Пикриновая кислота Метиловый оранжевый Лакмус Феноловый красный Фенолфталеин Ализариновый желтый | 0,0-2,0 3,1-4,4 6,0-8,0 6,8-8,4 8,2-10,0 10,1-12,1 | Бесцветная Красная >> Желтая Бесцветная Желтая | Желтая >> Синяя Красная Малиновая Оранжевая |

Гидролиз – результат поляризационного взаимодействия ионов соли с их гидратной оболочкой.
Соли - сильные электролиты:
КА ® Кm+ + An-
Гидролиз:
 Кm+ + НOH Û КОН(m-1)+ + H+
Кm+ + НOH Û КОН(m-1)+ + H+
 или
или

 An- + НОH Û HA(n-1)- + OH-
An- + НОH Û HA(n-1)- + OH-
малодиссоциированные изменение рН раствора
частицы
 Чем заряд и радиус иона Þ сильнее взаимодействие с Н2О Þ сильнее гидролиз.
Чем заряд и радиус иона Þ сильнее взаимодействие с Н2О Þ сильнее гидролиз.
DНг > 0 - эндотермический процесс.
Количественная характеристика гидролиза:
 |
 |
(для разбавленных растворов а = с)
Гидролиз – обратимый равновесный процесс
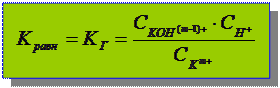
КГ - константа гидролиза
КГ зависит от: природы реагентов и Т.
 |
 Т.к. D Н Г > 0 Þ с температуры КГ Þ
Т.к. D Н Г > 0 Þ с температуры КГ Þ
выход продуктов гидролиза растет.
Применим закон разведения Оствальда:
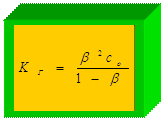
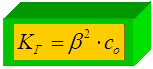

 | |||||
 | |||||
 | |||||






 | |||
 | |||
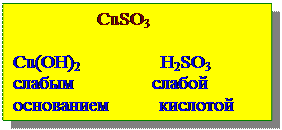
Соли, образованные сильной кислотой и сильным основанием (Na2SO4) – гидролизу не подвергаются.

 Na2SO4 ® Na+ + SO42-
Na2SO4 ® Na+ + SO42-
NaOH H2SO4
Сильное основание сильная кислота
раствор нейтральный: рН» 7.
 |
 Диссоциация соли: СН3СООNa ® CH3COO- + Na+
Диссоциация соли: СН3СООNa ® CH3COO- + Na+
CH3COOH NaOH
Слабая кислота сильное основание
Гидролиз – по слабому электролиту:
CH3COO- + НОН Û CH3COOH + ОН-
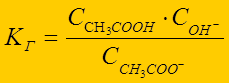 выражение константы гидролиза
выражение константы гидролиза
Гидролиз многозарядных ионов протекает ступенчато (FeCl3):
Fe3+ + НОН Û FeОН2+ + Н+ - 1-я ступень;
FeОН2+ + НОН Û Fe(ОН)2+ + Н+ - 2-я ступень;
Fe(ОН)2+ + НОН Û Fe(ОН)3 + Н+ - 3-я ступень
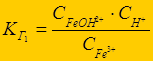
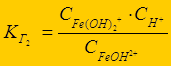

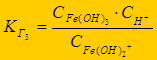 К г1> К г2 > К г3
К г1> К г2 > К г3

AgNO3 ® Ag+ + NO3-
 |  | ||
AgОН HNO3
слабое основание сильная кислота
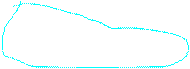 Ag+ + НОН Û AgОН + Н+.
Ag+ + НОН Û AgОН + Н+.
кислая среда рН< 7

 KW
KW
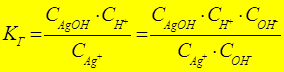
КД(AgOH): AgOH Û Ag+ + OH-
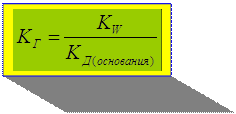 |
- константа гидролиза по
катиону
Если КГ (1-ой ступени) Þ КД (последней ступени)
Если КГ (последней ступени) Þ КД (1-ой ступени)
Расчет рН гидролиза по катиону:
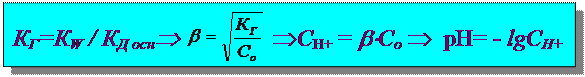


 Na2S ® Na+ + S2-
Na2S ® Na+ + S2-
NaOH H2S
сильное основание слабая кислота
 Гидролиз по ступеням:
Гидролиз по ступеням:
1cт.: S2- + HOН Û HS- + ОН-
2ст.: HS- + HOН Û H2S + ОН-

КГ( 1ст) > КГ( 2ст)

 кw
кw
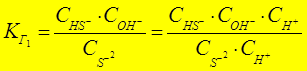

- константа гидролиза по аниону
(К г 1 Þ К Д последней)
Расчет рН гидролиза по аниону:
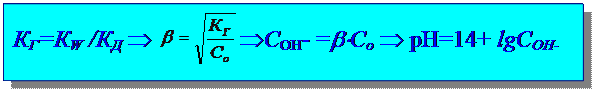
Гидролиз и по катиону и по аниону:

NН4СN, РbCO3, Аl2S3
NН4СN Û NН4+ + ОН-
Гидролиз:
СN- + НОН Û НСN + ОН-
NН4+ + НОН Û NН4ОН + Н+
NН4+ + СN- + Н2О Û NН4ОН + НСN
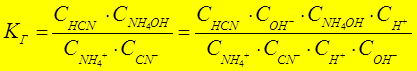
 |

К Д(NH4OH)=1,79×10-5 > К Д(НСN) =7,9×10-10 Þ

Концентрация соли не влияет на b Þ
Расчет рН гидролиза по катиону и аниону:
 |
Если в результате гидролиза Þ труднорастворимые или газообразные вещества Þ гидролиз необратимым:
PbCO3 + Н2О ® Pb(ОН)2¯ + CO2
 |
 1) при температуры:
1) при температуры:

 D Н Г > 0 Þ с температурыÞ К Г = b 2 × С 0;
D Н Г > 0 Þ с температурыÞ К Г = b 2 × С 0;
 2) с разбавлением раствора (концентрация);
2) с разбавлением раствора (концентрация);
 3) при концентрации иона, определяющего среду
3) при концентрации иона, определяющего среду
СN- + НОН Û НСN + ОН-
НСl ® Cl- + H+
Задача
Рассчитать К Г, b и рН 0,01 М раствора К2SО3.
Решение
Диссоциация сильного электролита К2SО3:
 К2SО3 ® 2К+ + SО32-
К2SО3 ® 2К+ + SО32-
КОН Н2SО3
Сильное основание слабая кислота
Гидролиз по SО32-:
1-ая ступень: SО32-+ НОН Û НSО3-+ОН-
К Г1 = 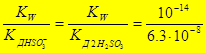 = 1,59×10-7
= 1,59×10-7
2-ая ступень: НSО3- + Н2О Û Н2SО3 + ОН-
К Г2 = 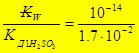 = 5,9×10-13 К Г1 > К Г2
= 5,9×10-13 К Г1 > К Г2
b = 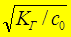 =
= 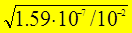 = 4×10-3 < 1 Þ расчет по приближенной формуле правомерен.
= 4×10-3 < 1 Þ расчет по приближенной формуле правомерен.
С OH- = b×c 0 = 4×10-3×10-2 = 4×10-5
рН = 14 + lg С OH- =14 - 4,4 = 9,6
 |
В насыщенных растворах сильных электролитов А n B m равновесие:
А n B m (тв) Û n A m +(p-р) + m B n -(p-р) - гетерогенный пр.
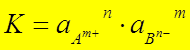 = ПРАnBm, т.к. а АnВm(тв) = const
= ПРАnBm, т.к. а АnВm(тв) = const


ПР зависит: от природы электролита и
растворителя, от температуры;
ПР не зависит от активностей ионов.
ПР25С –таблица
Пример: Ag2CO3(тв) Û 2Ag+(р-р) + CO32-(р-р)
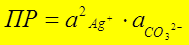
Если (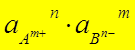 ) ³ ПРтабл – осадок выпадает
) ³ ПРтабл – осадок выпадает
Если (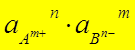 ) < ПРтабл – осадок не выпадает
) < ПРтабл – осадок не выпадает

с Р - растворимость - концентрация насыщенного раствора электролита
В насыщенном растворе:
А n B m (тв) Û n A m +(нас. p-р) + m B n -(нас. p-р)
С Р nс Р mс Р моль/л
ПР = 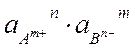 = (gА m+×n × с Р) n × (gB n-×m ×с Р) m=
= (gА m+×n × с Р) n × (gB n-×m ×с Р) m=
=( gА m+)n ×( gB n-)m × nn × mm ×(с Р) n+m
 |
- - растворимость
- труднорастворимого
сильного электролита
 если g ® 1
если g ® 1
Задача
Определить с Р MgF2, в растворе, в котором
g(Mg2+)=0,7, g(F-)=0,96
MgF2 Û Mg2+ (нас.р-р) + 2F-(нас.р-р)
ПР(MgF2) = 4×10-9 = 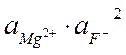
СР = 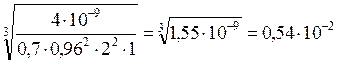 моль/л
моль/л
 |
1) ионной силы раствора – введение растворимого электролита, не имеющего общих ионов
 ПР = gMg2+ × С Mg2+ × С F-2 ×gF-2
ПР = gMg2+ × С Mg2+ × С F-2 ×gF-2

 С ионной силы раствора (I) Þ gi Þ C Р
С ионной силы раствора (I) Þ gi Þ C Р
Þ чтобы при Т=const Þ ПР =const
2) от введения одноименного иона
MgF2 Û Mg2+ (нас.р-р) + 2F-(нас.р-р)
NaF Û Na+ (р-р) + F-(р-р)

 С F- Þ равновесие смещается влево Þ С Р
С F- Þ равновесие смещается влево Þ С Р
 На этом явлении основано разделение элементов методом осаждения: растворимость СаСО3 и МgСО3 при введении в раствор хорошо растворимых К2СО3 или Nа2СО3 Þ ионы жесткости Са2+ и Мg2+ удаляются из раствора.
На этом явлении основано разделение элементов методом осаждения: растворимость СаСО3 и МgСО3 при введении в раствор хорошо растворимых К2СО3 или Nа2СО3 Þ ионы жесткости Са2+ и Мg2+ удаляются из раствора.
 2015-05-26
2015-05-26 3740
3740