В основе ионных равновесий в растворах электролитов лежат положения классической теории диссоциации электролитов. Согласно этой теории кислотой называется вещество, которое при диссоциации распадается на ионы водорода и кислотного остатка:
HAn = H+ + An-, (7.11)
а основанием - вещество, которое при диссоциации распадается на ионы металла и гидроксила:
MeOH = Me+ + OH- (7.12)
К процессу диссоциации применим закон действующих масс:
Kк = 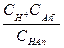 (7.13)
(7.13)
и
Кос. = 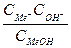 (7.14)
(7.14)
Если концентрация кислоты или основания С, а степень диссоциации α, то уравнения  для константы диссоциации кислоты (7.13) или основания (7.14) примут вид уравнения (7.3):
для константы диссоциации кислоты (7.13) или основания (7.14) примут вид уравнения (7.3):
К = 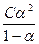 (7.15)
(7.15)
Из уравнений (7.11) и (7.12) видно, что при концентрации кислоты или основания С и степени диссоциации α, концентрация ионов водорода и гидроксила составит,
СН+ = Сα и СОН- = Сα (7.16)
С учётом этого уравнение (15) можно записать в виде:
Кк = 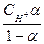 и Кос =
и Кос = 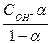 (7.17)
(7.17)
Для слабых кислот и оснований, когда α 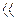 1, уравнение (7.17) принимает вид:
1, уравнение (7.17) принимает вид:
Кк = СН+α и Кос = СОН-α (7.18)
Концентрации ионов водорода и ионов гидроксила в растворах электролитов связаны между собой ионным произведением воды, Чистая вода является слабым электролитом и диссоциирует по уравнению:
Н2О = Н+ + ОН- (7.19)
Константа диссоциации воды выражается уравнением:
К = 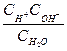 (7.20)
(7.20)
Поскольку степень диссоциации воды очень мала, то концентрацию воды СН 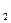 О можно считать постоянной величиной, тогда,
О можно считать постоянной величиной, тогда,
КН 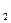 О = КСН
О = КСН 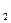 О = СН+СОН-, (7.21)
О = СН+СОН-, (7.21)
где КН 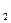 О – ионное произведение воды.
О – ионное произведение воды.
Ионное произведение воды зависит только от температуры. При температуре 298 К КН 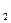 О = 10-14. Тогда после логарифмирования уравнения (7.21) получим для температуры 298 К:
О = 10-14. Тогда после логарифмирования уравнения (7.21) получим для температуры 298 К:
lg CH 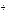 + lgCOH
+ lgCOH 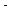 = -14. (7.22)
= -14. (7.22)
Величину (- lg CH 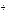 ) обычно обозначают через рН и называют водородным показателем, а величину (-lgCOH-) через рОН. Тогда для ионного произведения воды для Т =298 К можно записать:
) обычно обозначают через рН и называют водородным показателем, а величину (-lgCOH-) через рОН. Тогда для ионного произведения воды для Т =298 К можно записать:
рН + рОН = 14 (7.23)
Водородный показатель рН может служить мерой кислотности или щёлочности водных растворов электролитов. Чем ниже значение рН и выше значение рОН, тем больше кислотность раствора и наоборот. Если среда нейтральна, то:
СН+ = СОН- = 10-7 г-ион/л, (7.24)
или
рН = рОН = 7 (7.25)
Растворы с рН < 7 и рОН > 7 характеризуются кислой средой, а с рН > 7 и рОН < 7 – щелочной средой.
При расчете концентрации ионов Н+ и ОН- в растворах слабых кислот и оснований следует учитывать диссоциацию воды. Константа диссоциации слабой кислоты НАn выражается уравнение (7.13). Концентрация ионов водорода в растворе кислоты вследствие диссоциации воды и электронейтральности раствора составит:
СН 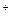 = САn
= САn 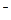 + СОН
+ СОН 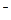 (7.26)
(7.26)
и, следовательно,
СН 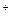 =
= 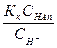 +
+ 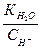 . (7.27)
. (7.27)
Откуда
СН+ = 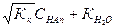 (7.28)
(7.28)
и для ионов гидроксила
CОН- = (КосСМеОН + КН 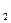 О)1/2 (7.29)
О)1/2 (7.29)
На основании классической теории электролитической диссоциации было введено понятие произведения растворимости малорастворимых солей. Процесс диссоциации малорастворимой соли АxBy протекает по уравнению:
Аν+Bν- = ν+Az+ + ν-Bz-. (7.30)
Произведение растворимости такой соли выражается уравнением:
ПР = (САz+)ν+(CBz-)ν- (7.31)
 2015-05-26
2015-05-26 8610
8610








