Классическая теория диссоциации электролитов сыграла положительную роль в решении ряда задач в химии. Она даёт удовлетворительные результаты при описании слабых электролитов. Согласно этой теории растворы электролитов представляют собой идеальные растворы. Однако применение её к описанию сильных электролитов наталкивается на ряд трудностей. Даже в разбавленных растворах сильные электролиты не ведут себя как идеальные растворы. Это обстоятельство заставило пересмотреть классическую теорию электролитической диссоциации применительно к сильным электролитам. Поэтому была разработана электростатическая теория сильных электролитов, авторами которой были Дебай и Хюккель(1923). При выводе теории они исходили из следующих предположений:
1) В разбавленных растворах сильные электролиты нацело диссоциированы на ионы.
2) Между ионами имеет место только кулоновское электростатическое взаимодействие.
3) Каждый ион в растворе окружён сферой противоположно заряженных ионов.
4) В растворе имеет место статистическое распределение (распределение Больцмана) ионов.
5) Электростатическое взаимодействие рассматривается как взаимодействие центрального иона с его ионной атмосферой.
6) Ионы рассматриваются как бесструктурные шарики, что позволяет пренебречь их размером.
7) Диэлектрическая постоянная растворителя не изменяется с растворением в нём электролита.
Электростатическая теория позволила рассчитать радиус ионной атмосферы вокруг центрального иона и на его основе вывести уравнение для среднего коэффициента активности ионов:
lgγ± = - | z+z-|h 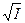 , (7.32)
, (7.32)
где γ± - средний коэффициент активности ионов; z+ и z- - степень окисления ионов;
h –постоянная, зависящая от природы растворителя и температуры;
I – ионная сила раствора.
Ионная сила раствора выражается уравнением:
I = ΣCizi2 = 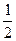 (С1z12 + C2z22 + ··· + Cizi2) (7.33)
(С1z12 + C2z22 + ··· + Cizi2) (7.33)
Для водных растворов электролитов при Т = 298К величина h = 0, 509, тогда для водных растворов электролитов уравнение (7.32) примет вид:
lgγ± = -0,509| z+z-| 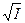 . (7.34)
. (7.34)
Для индивидуального сорта ионов уравнение (7.34) можно представить следующим образом:
lgγi = - 0,509zi2 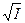 , (7.35)
, (7.35)
где γi – коэффициент активности i – го сорта ионов. Уравнение (7.32) применимо к сильно разбавленным растворам электролитов, ионная сила которых не превышает 0,003. Оно называется предельным законом Дебая - Хюккеля.Из него следует, что при постоянной ионной силе электролита средний коэффициент активности в предельно разбавленном растворе является постоянным и не зависит от природы других электролитов в растворе. Таким образом, в предельном законе Дебая –Гюккеля получает теоретическое обоснование правило ионной силы. Для более концентрированных растворов. Уравнение (7.32) было выведено без учёта размера иона. С учётом размера Дебай и Хюккель получили более точное уравнение, применимое для более концентрированных электролитов с ионной силой до 0,1:
lgγ± = - 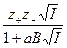 , (7.36)
, (7.36)
где 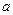 - расстояние, на которое могут сблизиться два разноимённых иона электролита, равное сумме разноименных ионов; В – теоретический коэффициент, равный для водных растворов при Т = 298 К 0,33∙108. Уравнение (36) получило название уравнения второго приближения. Для ещё более концентрированных растворов было получено уравнение, учитывающее изменение диэлектрической постоянной раствора с изменением концентрации электролита:
- расстояние, на которое могут сблизиться два разноимённых иона электролита, равное сумме разноименных ионов; В – теоретический коэффициент, равный для водных растворов при Т = 298 К 0,33∙108. Уравнение (36) получило название уравнения второго приближения. Для ещё более концентрированных растворов было получено уравнение, учитывающее изменение диэлектрической постоянной раствора с изменением концентрации электролита:
lgγ± = - 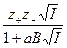 + СI, (7.37)
+ СI, (7.37)
где С – постоянная, которая подбирается опытным путём. Уравнения, полученные Дебаем и Гюккелем, всё же не всегда соответствуют опытным данным, что говорит о несовершенстве электростатической теории сильных электролитов. Таким образом, в настоящее время не существует строгой теории, которая бы позволяла рассчитывать средний коэффициент активности электролитов в области высоких концентраций электролита.
 2015-05-26
2015-05-26 2439
2439
