В растворах сильных электролитов имеет место электростатическое взаимодействие между ионами, поэтому обычно эти растворы не являются идеальными. В этом случае для анализа таких растворов целесообразно использовать уравнение химического потенциала, выраженного через активность. Рассмотрим электролит Аν+Вν-,который при растворении будет полностью диссоциировать на ионы:
Аν+Вν- = ν+Az+ + ν-Bz- (7.38)
Уравнение химического потенциала для соли и ионов будет иметь вид:

 μs = μs0 + RTln
μs = μs0 + RTln 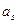 и μ i= μ10 + RTln
и μ i= μ10 + RTln 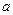 I (7.39)
I (7.39)
где 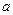 s и
s и 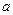 i -- активность соли и i- го иона, соответственно. Химический потенциал соли связан с химическим потенциалом катионов и анионов соотношением
i -- активность соли и i- го иона, соответственно. Химический потенциал соли связан с химическим потенциалом катионов и анионов соотношением
μs = ν+μ+ + ν-μ- (7.40)
После подстановки получим
μs0 + RTln 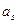 = ν+ μ+0 + ν+RTln
= ν+ μ+0 + ν+RTln 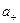 + ν- μ-0 + ν-RTln
+ ν- μ-0 + ν-RTln 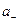 (7.41)
(7.41)
Из условия электронейтральности раствора в стандартном состоянии можно записать
 μso = ν+0 μ+0 + ν-μ-0 (7.42)
μso = ν+0 μ+0 + ν-μ-0 (7.42)
Таким образом, можно записать
RTIn 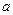 s = ν+RTln
s = ν+RTln 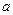 + + ν- RTln
+ + ν- RTln 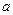 - (7.43)
- (7.43)
или
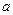 s =
s = 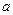 +ν+
+ν+ 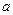 -ν- (7.44)
-ν- (7.44)
При описании свойств растворов электролитов пользуются понятием средней активности.
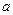 ± =
± = 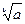 s = (
s = (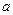 ν+
ν+ 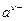 )
) 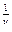 (7.45)
(7.45)
где ν = ν+ + ν-.
Откуда
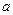 s =
s = 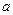 ±ν (7.46)
±ν (7.46)
C учетом коэффициента активности для различных выражений активности i – го сорта ионов можно записать:
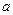 i = γibi,
i = γibi, 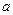 i = γiCi и
i = γiCi и 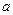 i = γiXi, (7.47)
i = γiXi, (7.47)
где γi - коэффициент активности; bi –моляльная концентрация; Сi - молярная концентрация; Хi – концентрация i – го сорта ионов, выраженная в молярных долях.
Или
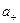 = γ+b+ = ν+γ+b и
= γ+b+ = ν+γ+b и 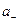 = γ-b- = ν-γ-b, (7.48)
= γ-b- = ν-γ-b, (7.48)
где b – моляльная концентрация электролита.
Для средней активности электролита можно записать:
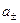 =
= 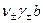 , (7.49)
, (7.49)
где
γ± = (γ+ν+γ-ν-) 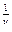 (7.50)
(7.50)
и
ν± = (ν+ν+ν-ν-) 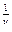 . (7.51)
. (7.51)
Растворы малорастворимых солей, как правило, представляют собой реальные растворы электролитов. Тогда для малорастворимой соли Аν+Bν-, которая диссоциирует по уравнению
Аν+Bν- = ν+Az+ + ν-Bz , (7.52)
произведение растворимости выражается уравнением
ПР = 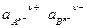 , (7.53)
, (7.53)
где 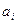 - активность i – го сорта ионов.
- активность i – го сорта ионов.
 2015-05-26
2015-05-26 859
859







