Химические источники тока
Химическими источниками тока (ХИТ) называются электрохимические устройства, в результате работы которых химическая энергия окислительно-восстановительных процессов превращается в электрическую энергию постоянного тока. К ним относятся гальванические элементы, аккумуляторы, топливные элементы. Во всех видах химических источников тока используются электролиты – водные, неводные, твердые. К преимуществам современных ХИТ относятся относительно высокие КПД (до 0,8) и высокая удельная мощность (количество энергии, отдаваемое в единицу времени единицей массы ХИТ), что позволяет им конкурировать с другими источниками тока. Основным их недостатком является ограниченный срок службы.
Гальванические элементы состоят из двух электродов, имеющих различный электродный потенциал, электролита, который дает возможность перемещаться ионам от одного электрода к другому, и металлического проводника электронов, в результате потока которых может быть получена электрическая энергия постоянного тока.
Среди большого разнообразия гальванических элементов можно выделить три основных типа.
Первый тип. Пластины из двух различных металлов находятся в растворах солей, содержащих собственные ионы. К этому типу относится медно-цинковый гальванический элемент (элемент Даниэля – Якоби).
Второй тип. Пластины из двух различных металлов находятся в растворе одного электролита. Примером может служить элемент Вольта, состоящий из двух пластин (Zn и Cu), погруженных в раствор серной кислоты. При его работе происходят следующие процессы:
(-) А: Zn «Zn2++ 2 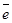 - окисление (анодный процесс);
- окисление (анодный процесс);
(+) К: 2Н++ 2 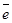 «Н2
«Н2 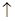 - восстановление (катодный процесс).
- восстановление (катодный процесс).
Выделяющийся водород насыщает поверхность катода (меди), в результате чего получается электрод другого состава (не медный, а водородный). Схема гальванического элемента Вольта:
2 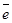
 |
(-) Zn / Zn2+ç H2SO4 ç 2H+ / H2 (Cu) (+)
В скобках справа указывается (Сu) - место выделения водорода.
Третий тип. Гальванические элементы составлены из двух совершенно одинаковых по природе электродов (например, медных), погруженных в растворы одного и того же электролита, но различной концентрации. Такие элементы называются концентрационными.
Схема медного концентрационного гальванического элемента:
2 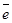
 |
(-) Cu / CuSO4 çç CuSO4 / Cu (+),
C1 < С2
где C1 и С2 - концентрация раствора электролита, моль/л.
Роль анода выполняет электрод, находящийся в более разбавленном растворе, так как его электродный потенциал имеет более низкое значение по сравнению со вторым электродом. ЭДС такого гальванического элемента зависит только от соотношения концентраций потенциалопределяющих ионов (в данном случае от концентрации CuSO4).
Практического значения как источники электрической энергии, концентрационные гальванические элементы не имеют.
Аккумуляторы – гальванические элементы, которые на основе обратимых электрохимических реакций могут многократно накапливать химическую энергию и отдавать ее для потребления в виде электрической энергии постоянного тока.
Аккумуляторы - устройства многоразового действия, сочетающие в себе гальванический элемент и электролизер. Под воздействием внешнего постоянного тока в них аккумулируется (накапливается) химическая энергия, которая затем превращается в электрическую в результате окислительно-восстановительной реакции. Процесс накопления химической энергии называют зарядом аккумулятора, процесс ее превращения в электрическую - разрядом аккумулятора. В первом случае аккумулятор работает как электролизер, во втором – как гальванический элемент.
Устройство и принцип действия всех аккумуляторов одинаковы. Основное отличие состоит в материале электродов и типе электролита. На аноде как при разряде, так и при заряде протекает процесс окисления, на катоде – процесс восстановления.
Наиболее распространенными являются кислотные и щелочные аккумуляторы.
Кислотный аккумулятор (свинцовый аккумулятор) представляет собой пластины в виде отливок из хартблея (твердого свинца с примесью сурьмы) ячеистой структуры, собранные в батареи и помещенные в баки из эбонита или полипропилена с электролитом. В ячейки пластин предварительно запрессовывается смесь оксида свинца (PbO) с глицерином, обладающая способностью затвердевать в виде глицерата свинца. Электролитом служит раствор серной кислоты (35…40 % раствора H2SO4). При взаимодействии оксида свинца с H2SO4 образуется PbSO4.
PbOтв. + H2SO4(р-р) 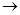 PbSO4тв. + H2O.
PbSO4тв. + H2O.
При первичном и последующих зарядах аккумулятора, когда он работает как электрохимическая ячейка, PbSO4 на катоде превращается в свинец Pb, а аноде - в диоксид свинца PbO2, которые и являются электродами:
(-) К: PbSO4(тв) + 2 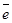
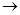 Pb( тв) + SO
Pb( тв) + SO 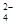 (р-р)
(р-р)
(+) А: PbSO4(тв) +2 Н2О 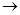 PbО 2(тв) + 2
PbО 2(тв) + 2 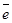 + 4 Н+ + SO
+ 4 Н+ + SO  (р-р)
(р-р)

2PbSO4(тв) + 2H2O 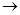 Pb(тв) + PbO2(тв) + 2 H2SO4(р-р)
Pb(тв) + PbO2(тв) + 2 H2SO4(р-р)
ЭДС заряженного аккумулятора приблизительно равна 2 В (если 6 таких аккумуляторов последовательно соединить, получается обычный автомобильный аккумулятор с ЭДС = 12В).
При работе аккумулятора – его разрядке, когда он работает как химический источник тока, на электродах протекают электродные процессы в обратном направлении.
По мере его разрядки расходуются материалы катода (PbО2), анода (Pb) и электролит - серная кислота. Напряжение на зажимах аккумулятора падает, и его необходимо заряжать. Для зарядки аккумулятор подключают к внешнему источнику тока, направление тока противоположно разрядному.
Токообразующие и электродные реакции в свинцовом аккумуляторе можно представить в виде
Pb(тв) + SO 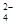 (р-р) «PbSO4(тв) + 2
(р-р) «PbSO4(тв) + 2 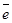
PbО2(тв) + 2 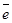 + 4 Н+(р-р)+ SO
+ 4 Н+(р-р)+ SO 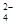 (р-р) «PbSO4(тв) + 2 Н2О
(р-р) «PbSO4(тв) + 2 Н2О

 «разрядка»
«разрядка»
Pb(тв) + PbO2(тв) + 2 H2SO4 (р-р) «2 PbSO 4(тв) + 2H2O
 «зарядка»
«зарядка»
Cхема кислотного аккумулятора
(-) Pb / Pb2+ │H2SO4 │Pb2+ / PbO2 (+)
Стандартные величины потенциалов для электродов свинцового аккумулятора имеют следующие значения: 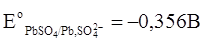 ,
, 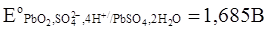 .
.
ЭДС аккумулятора как химического источника тока рассчитывается по уравнению
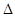
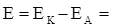
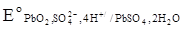 -
- 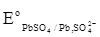 +
+ 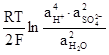 .
.
Из данного уравнения видно, что ЭДС аккумулятора зависит от концентрации (активности) серной кислоты, которая возрастает при заряде аккумулятора и уменьшается при его разряде. О степени разряда аккумулятора судят по концентрации электролита, т.е. концентрации H2SO4. Используя концентрированные растворы H2SO4, можно было бы увеличить ЭДС аккумулятора, однако при концентрации H2SO4 больше 39% резко уменьшается электропроводность растворов и увеличивается растворимость свинца, поэтому оптимальными являются 32…39 % - ные растворы H2SO4.
Во время заряда аккумулятора растет напряжение на его полюсах. В конце оно достигает такого значения, что начинается электролиз воды, сопровождающийся выделением водорода на катоде и кислорода – на аноде:

 (-) К: 2 Н2О + 2
(-) К: 2 Н2О + 2 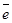 «Н2
«Н2 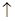 +2 ОН-
+2 ОН-
(+) А: 4 ОН- «О2  + 2 Н2О + 4
+ 2 Н2О + 4 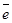

2 Н2О «2 Н2  + О2
+ О2 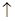
Так называемое «кипение» электролита является признаком окончания заряда свинцового аккумулятора. Заряженный аккумулятор может быть сразу использован по назначению. При хранении же из него выливают электролит и промывают водой. В таком виде он может находиться до 2 лет, и для его использования достаточно лишь залить электролит. При хранении незаряженного аккумулятора с раствором серной кислоты происходит его «сульфатирование» – образование на пластинках большого количества PSO4. Когда кислотный аккумулятор работает, давая ток, PSO4 осаждается в очень мелкозернистой форме на поверхности электродов. Когда же аккумулятор выключен, мелкозернистый слой рекристаллизуется и образуются более крупные кристаллы, которые могут закупорить поры электрода, уменьшая его поверхность, или отрываться от электрода и оседать на дно аккумулятора. Процесс сульфатации является основной причиной выхода аккумулятора из строя, поэтому нужно следить, чтобы аккумулятор не простаивал частично в разряженном состоянии.
Преимущества свинцового аккумулятора – высокий КПД (около 80 %), высокая ЭДС и относительно малое ее изменение при разряде, большая электрическая емкость, устойчивость в работе. Недостатки – большая масса и, следовательно, малая удельная емкость, саморазряд аккумулятора при хранении, малый срок службы (2…5 лет), а также токсичность свинца и сильные окислительные свойства H2SO4.
Щелочные аккумуляторы различаются по материалу пластин отрицательно заряженного электрода. Наиболее распространенные из них кадмий - никелевые (Cd - Ni) и железо - никелевые (Fe – Ni) аккумуляторы. Активная масса положительных пластин состоит в основном из гидратированного оксида никеля (III). Кроме того в ней содержится графит, добавляемый для увеличения электропроводности. Электролитом служит раствор КОН (20 %), содержащий небольшое количество LiOH. ЭДС заряженного аккумулятора (Cd - Ni) приблизительно равна 1,3 В.
Cхемы щелочных аккумуляторов
(-) Cd │KOH, LiOH │NiO(OH), C (+)
(-) Fe │KOH, LiOH │NiO(OH), C (+)
Окислительно-восстановительные процессы, протекающие при работе щелочного аккумулятора (Сd – Ni), могут быть представлены следующими уравнениями:
(-) A: Cd + 2 OH- 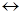 Cd (OH)2 + 2
Cd (OH)2 + 2 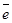

 (+) K: 2 NiO(OH) + 2 H2O + 2
(+) K: 2 NiO(OH) + 2 H2O + 2 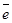
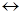 2 Ni(OH)2 + 2 OH -
2 Ni(OH)2 + 2 OH -

2 NiO(OH) + 2 H2O + Cd  Cd(OH)2 + 2 Ni(OH)2
Cd(OH)2 + 2 Ni(OH)2
В отличие от свинцового аккумулятора срок службы щелочных аккумуляторов порядка 10 лет. Они хорошо выдерживают перегрузку и длительное время пребывания в разряженном состоянии. Однако меньшая ЭДС и более высокая стоимость не позволяют во многих случаях заменить ими свинцовые аккумуляторы. Щелочные аккумуляторы выпускаются промышленностью различной удельной емкости (0,5 – 120 А  ч).
ч).
В последние годы проводятся исследования по совершенствованию существующих и созданию новых аккумуляторов. Это обусловлено необходимостью создания экологически чистых автомобилей (электромобилей, не дающих вредных выбросов в окружающую среду) и длительного пребывания в космосе. Разрабатываются металл-газовые аккумуляторы (цинк-кислородные, никель-водородные, железо-воздушные и другие.) с большим сроком службы. Среди новых аккумуляторов – аккумуляторы со щелочными анодами, неводными растворами электролитов (расплавы и твердые электролиты) и катодами на базе оксидов кобальта, никеля, марганца и ванадия. Они имеют, как правило, высокие удельную энергию и КПД.
Топливные элементы (ТЭ) – перспективные химические источники тока (электрохимические генераторы), способные непрерывно работать за счет постоянного подвода к электродам новых порций реагентов и отвода продуктов реакции. Топливными элементами называются устройства, в которых химическая энергия окисления топлива превращается в электрическую энергию.
На практике наиболее часто применяются водородно-кислородный топливный элемент (рис. 4.4).
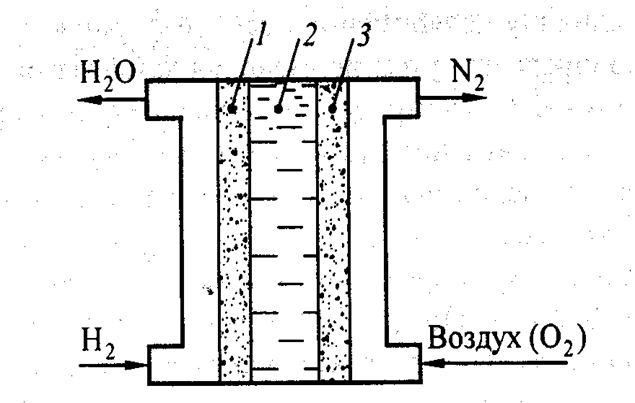
Рис. 4.4. Схема водородно-кислородного топливного элемента:
1 – анод; 2 – электролит; 3 - катод
Устройство элемента чрезвычайно простое. В герметически закрытом сосуде установлено два пористых, металлических (чаще всего никелевых) электрода, разделенных слоем раствора гидроксида калия (натрия). В прибор подаются газообразный водород и кислород.
Схема водородно-кислородного ТЭ имеет следующий вид:





 А (-) Ме, Н2 KOH, NaOH O2, Me, (+) K,
А (-) Ме, Н2 KOH, NaOH O2, Me, (+) K,
где Ме - проводник первого рода, играющий роль катализатора электродного процесса и токоотвода (например, специально обработанные Ni, Co, металлы группы Pt).
Элемент работает при 50…70 оС, при атмосферном давлении. На электродах протекают следующие реакции:
на аноде – окисление водорода
(-) А: H2 + 2OH- «2 H2O + 2 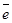 ;
;
 2015-05-26
2015-05-26 2744
2744







