Закон эквивалентов.
!!! Вещ-ва взаимодействуют между собой в строго определённых массовых соотношениях или эквивалентов.
Эквивалент – реальная или условная частица вещества, которая в кислотно-основных реакциях эквивалентна одному иону водорода, а в окислительно-восстановительных – одному электрону.
Эквивалентная масса – масса эквивалента, выраженная в граммах.
mэ=A/B, где А – атомная масса элемента, В – валентность.
Пример: mэ(Al)=27/3=9 г/моль
Эквивалентная масса в соединениях
mэ(кислоты)=М(кислоты)/nH^+ mэ(основания)=М(основания)/nOH^- mэ(cоли)= M(соли)/nMe*Вме mэ(оксида)=M(оксида)/nэ*Вэ m1/mэ1=m2/mэ2
Эквивалентный объем - объём одного эквивалента газа при нормальных условиях.
Vэ=Vm/n(атома)*В(атома) m1/mэ1=V2/Vэ2
Закон кратных отношений
!!! если 2 элемента образуют друг с другом хим соединение, то масса одного элемента, приходящейся в этих соединениях на одну и ту же массу другого элемена, относятся между собой как простые целые числа.
Относительная атомная масса – показывает, во сколько раз масса данного атома превышает 1/12 часть массы лёгкого изотопа углерода 12 С.
Относительная молекулярная масса- показывает во сколько раз масса одной молекулы превышает 1/12 часть массы лёгкого изотома атома углерода 12 С.
Закон Авогадро: Установлен 1811
!!! В равных объёмах любых газов при одинаковых физ условиях содержится одинаковое число частиц (атомов, молекул, ионов). Авогадро доказал, что в молях любых веществ содержится одинаковое количество частиц NA=6,02* 
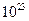
Моль - единица количества вещ-ва, содержащая столько условных частиц, сколько атомов содержится в 12 граммах лёгкого изотома атома углерода 12 С.
Условная частица – это любая реальная частица или часть этой частицы.
Уравнение состояния газа или уравнение Менделеева - Клапейрона:
pV=nRT; R=8,314 Дж/моль*К; n=m/M моль
Валентность элемента – способность его атомов соединяться с другими атомами в определённых соотношениях.
3.Основные сведения о строении атомов. Квантово-механическая модель атома. Волновые свойства электронов.
Квантово-механическая модель атомов. Уравнение Луи де Бройля. В1920-х годах доказано двойственная природасфера, согласно которой свет - двойственный объект, в одних экспериментах как волновой объект, в других – как состоящий из материальных частиц.
Длина волны l=h/mu
Гейзинберг предложил принцип неопределённости: невозможно одновременно с одинаково большой точностью указать положение электрона в атоме и его импульс.
Шредингер сказал, что характер волнового движения электрона в атоме близок волновому движению типа «стоячая» волна. Квадрат волновой функции характеризует вероятность нахождения электрона в данной области пространства атома.
Область пространства, в которой можно найти электрон – электронное облако.
Атом состоит из положительно заряженного ядра, в котором сосредоточена преобладающая часть массы атома, и вращающихся вокруг него электронов. Положительный заряд ядра нейтрализуется суммарным отрицательным зарядом электронов, так что атом в целом электронейтрален. Возникающая вследствие вращения электронов центробежная сила уравновешивается силой электростатического притяжения электронов к противоположно заряженному ядру. Размеры ядра очень малы по сравнению с размерами атома в целом: диаметр атома — величина порядка 10~8 см, а диаметр ядра — порядка 1(Н3)
4.Квантовые числа электронов. Распределение электронов по орбиталям. Принцип Паули. Порядок заполнения атомных орбиталей электронами.
Возможные энергетические состояния электрона в атоме определяются
величиной главного квантового числа п, которое может принимать положительные целочисленные значения: 1, 2, 3... и т. д. Наименьшей энергией электрон обладает при n = 1; с увеличением п энергия электрона возрастает. Поэтому состояние- электрона, характеризующееся определенным значением главного квантового числа, принято называть энергетическим уровнем электрона в атоме: при п — 1 электрон находится на первом энергетическом уровне
Не только энергия электрона в атоме (n связанный с ней размер электронного облака) может принимать лишь определенные значения. Произвольной не может быть и форма электронного облака. Она определяется орбитальным квантовым числом / (его называют также побочным, или азимутальным), которое может принимать целочисленные значения от 0 до (п —1), где п — главное квантовое число.
Размеры иформы электронных облаков в атоме могут быть не любыми, а только такими, которые соответствуют возможным значениям квантовых чисел п и I. Из уравнения Шредингера следует, что и ориентация электронного облака в пространстве не может быть произвольной: она определяется значением третьего, так называемого магнитного квантового числа т.
Магнитное квантовое число может принимать любые целочисленные значения — как положительные, так и отрицательные — в пределах от +/ до —/. Таким образом, для разных значений / число возможных значений т раз-лично. Так, для s-электронов (/==0) возможно только одно значение т (т = 0); для р-электронов (/=1) возможны три различных значения т (—1,0, +1); при 1 = 2 (f-электроны) т может принимать пять различных значений (—2,—1,0,+1,4-2). Вообще, некоторому значению I соответствует (2/+ 1) возможных значений магнитного квантового числа, т. е. (2/+I) возможных расположений электронного облака в пространстве.
Исследования атомных спектров привели к выводу, что, помимо квантовых чисел п, I и т, электрон характеризуется еще одной квантованной величиной, не связанной с движением электрона вокруг ядра, а определяющей его собственное состояние. Эта величина получила название спинового квантового числа или просто спина (от английского spin — кручение, вращение); спин обычно обозначают буквой s. Спин электрона может иметь только два значения: +1/2 или —1/2; таким образом, как и в случае остальных квантовых чисел, возможные значения спинового квантового числа различаются на единицу.
(Принцип Паули), согласно которому в атоме не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковыми.
Первое правило Клечковского: заполнение подуровней происходит в направлении увеличения суммы главного и орбитального квантовых чисел.
Второе правило К л е ч к о в с к о г о: если для 2-х подуровней сумма главного и орбитального квантовых чисел одинаковы, то в начале полностью заполняется подуровень с меньшим значением главного квантового числа.
 2015-05-30
2015-05-30 841
841







