усилительную аппаратуру, а не теряются в месте контакта пэтч-пипетки с клеткой. При использовании пэтч-кламп метода регистрируемые события состоят из прямоугольных токовых сигналов, отражающих процессы открытия и закрытия одиночных ионных каналов. Таким образом, мы в реальном времени можем наблюдать активность одиночных белковых молекул мембраны.
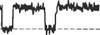
В простом случае токи одиночных каналов появляются нерегулярно и с различной продолжительностью, но с постоянной амплитудой (рис. 2.4А). В некоторых случаях, однако, картина токов может быть более сложной. Некоторые ионные каналы, например, в открытом состоянии могут иметь более чем
один уровень проводимости, как это показано на рис. 2.4В. Кроме того, ионные каналы могут проявлять комплексную кинетику. Например, ток через одиночный ионный канал может выглядеть не как простой прямоугольник, а как «вспышка» открытий канала (рис.2.4С).
Таким образом, пэтч-кламп метод предоставляет новые уникальные возможности для изучения поведения ионных каналов. Во-первых, изоляция маленького участка мембраны позволяет наблюдать активность всего нескольких ионных каналов, а не тысяч, которые активируются в целой клетке. Во-вторых, высокое сопротивление контакта дает возможность регистрировать даже крайне
Раздел П. Передача информации в нервной системе

|
|
(А)
| [ |
Closed (С) Open - <Р) 20 рА

|

|

|
(В)
4рА
(С) (О,)



 100
100
100 0

|
2рА
200 400 600 800 1000 1200 1400
Time (ms)
Рис. 2.4. Примеры одиночных ионных каналов, зарегистрированных методом пэтч кламп
Fig. 2.4. Examples of Patch Clamp Recordings. (A) Glutamate-activated channel currents recorded in a cell-attached patch from locust muscle occur irregularly, with a single amplitude and varied open times. Downward deflections indicate current flowing into the cell. (B) Acetylcholine-activated currents from single channels in an outside-out patch from cultured embryonic rat muscle reach a maximum amplitude of about 3 pA and relax to a substate current of about 1,5 pA. Downward deflections indicate inward current. (C) Pulses of outward current through glycine activated chloride channels in an outside-out patch from cultured chick spinal cord cells are interrupted by fast closing and reopening transitions to produce bursts. (A after Cull-Candy, Miledi, and Parker, 1980; В after Hamill and Sakmann, 1981; С from A. I. McNiven and A. R. Martin, unpublished.)
малые токи. В результате мы имеем возможность точного измерения амплитуд токов одиночных ионных каналов и можем провести анализ кинетики каналов.
 2015-05-30
2015-05-30 504
504








