1 - Подземная газификация – добыча полезных ископаемых переводом в газообразное состояние. Например, из угля получают газ, используемый для химических и энергетических целей.
В процессе газификации формируются три основные зоны: окислительная, восстановительная и сухой перегонки.
Используют разные виды дутья: воздушное, обогащенное кислородом (35-65%), воздушно-паровое и парокислородное (60% кислорода и 230 г/м3 пара).
При этом получают газ, содержащий CO2, CO, H2, CH4, N2, имеющий теплоту сгорания до 7 МДж/м3.
Возможна одновременная газификация и перегонка нефти. При этом сжигают 10-12% нефти, получаемые при этом газообразные и жидкие продукты выводятся на поверхность через скважины.
Отсутствуют затраты на прокладку выработок, нет металлозатрат, облегчается труд шахтеров.
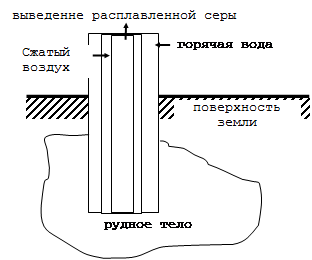 2 – Подземная выплавка веществ из рудного тела осуществляется подачей через трубы горячей воды и сжатого воздуха. Например, температура плавления серы равна 114-119оС. При этом получают серу чистотой 99,99% без примесей селена, теллура, мышьяка.
2 – Подземная выплавка веществ из рудного тела осуществляется подачей через трубы горячей воды и сжатого воздуха. Например, температура плавления серы равна 114-119оС. При этом получают серу чистотой 99,99% без примесей селена, теллура, мышьяка.
Таким способом можно добывать минералы с низкой температурой плавления: буру (Na2B4O7*10H2O), озокерит (горный воск, парафиновые углеводороды), асфальт. Все эти вещества плавятся при 80-90оС.
3 – Выщелачивание руд.
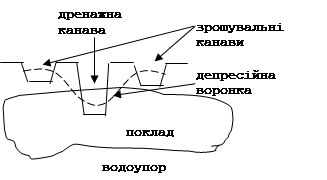 Может быть открытым, когда выщелачивающий раствор вводится и выводится системой дренажных канав
Может быть открытым, когда выщелачивающий раствор вводится и выводится системой дренажных канав
или
подземным, когда раствор вводится и выводится системой вертикальных нагнетательных и разгрузочных скважин, соединенных в ряды.
Виды выщелачивания:
- простое растворение (протекает без химических реакций). В этом случае вещество извлекается в продуктивный раствор в виде того соединения, которое содержится в исходной руде. Например, NaCl, NaNO3, KNO3, NaCl+KCl (сильвинит), NH4Cl, KCl*MgCl2*6H2O (карналлит), MgCl2*6H2O (бишофит), а также сульфаты, карбонаты.
- выщелачивание, протекающее с химическими реакциями. Его проводят в рудах, компоненты которых находятся в плохорастворимых соединениях. В результате реакции они переходят в хорошо растворимую форму, например:
2MeS + 2H2SO4 + O2 = 2MeSO4 + 2S + 2H2O
или
Cl2 + H2O = HOCl(гипохлоритная кислота, окислитель) + HCl,
затем
3MeS + HOCl + HCl = Me2(SO$)3 + MeCl2 + H2O
Применяемые растворители:
- природные поверхностные и подземные пресные воды,
- природные воды с добавкой газов (воздух, O2, CO2, Cl2),
- кислые растворители (H2SO4, HCl, HNO3),
- кислые растворы с добавками окислителей (например, раствор H2SO4 с добавками NO3-, Fe2(SO4)3),
- щелочные растворы (NH4OH – для выщелачивания бромаргирита AgBr, W, Co; NaOH – для выщелачивания Al),
- растворы Na2SO3 FeCl2 для выщелачивания соединений Sb,
- 0,05-0,15% раствор KCN – для выщелачивания соединений Au.
Взаимодействие этих способов добычи с окружающей средой пока не изучено.
 2015-05-30
2015-05-30 647
647








