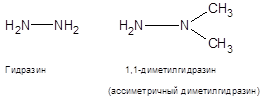
Гидразин (диамид) — бесцветная, сильно гигроскопическая жидкость с неприятным запахом, напоминающим запах аммиака. Молярная масса32,05 г/моль, плотность1,01 г/см2, температура плавления +1 °C, температура кипения +114 °C. Разлагается при нагревании. Гидразин и его производные (монометил-гидразин и диметилгидразин) — легковоспламеняющиеся вещества; горят с образованием высокотоксичных летучих нитросоединений.
Молекула N2H4 состоит из двух групп NH2, повёрнутых друг относительно друга, что обусловливает полярность молекулы гидразина. Смешивается в любых соотношениях с водой, жидким аммиаком, этанолом; в неполярных растворителях растворяется плохо. По устойчивости гидразин значительно уступает аммиаку, так как связь N—N не очень прочная.Благодаря наличию двух неподелённых пар электронов у атомов азота, гидразин способен к присоединению одного или двух ионов водорода. При присоединении одного протона получаются соединения гидразиния с зарядом 1+, двух протонов — гидразиния 2+, содержащие соответственно ионы N2H5+ и N2H62+. Водные растворы гидразина обладают основными свойствами, но его основность значительно меньше, чем у аммиака. Известны соли гидразина — хлорид N2H5Cl, сульфат N2H6SO4 и т. д. Большинство таких солей растворимо в воде.Соли гидразина бесцветны, почти все хорошо растворимы в воде.
Гидразин применяют в органическом синтезе, в производстве пластмасс, резины, инсектицидов, взрывчатых веществ, в качестве компонента ракетного топлива. Гидразин и все его производные сильно ядовиты. Гидразин — энергичный восстановитель.Окисляется кислородом воздуха до азота, аммиака и воды. Известны многие органические производные гидразина. Гидразин, а также гидразин-гидрат, гидразин-сульфат, гидразин-хлорид, широко применяются в качестве восстановителей золота, серебра, платиновых металлов из разбавленных растворов их солей. Медь в аналогичных условиях восстанавливается до закиси. Гидразин и его производные, такие как Метилгидразин, НДМГ и Аэрозин широко распространены как ракетные горючие. Они могут быть использованы в паре самыми разными окислителями, а некоторые и в качестве однокомпонентного топлива, в этом случае рабочим телом двигателя являются продукты разложения на катализаторе. Последнее удобно для маломощных двигателей. Во время Второй мировой войны гидразин был применён в Германии на реактивных истребителях «Мессершмитт Ме-16З».Гидразин широко применяется в качестве топлива в гидразин-воздушных низкотемпературных топливных элементах. Нитрат и перхлорат гидразина применяются в качестве очень мощных взрывчатых веществ — разных сортов астролита. Они обладают большой скоростью детонации. Жидкая смесь гидразина и нитрата аммония используется как мощное взрывчатое средство с нулевым кислородным балансом.
Гидразин и его производные — чрезвычайно токсичные соединения по отношению к различным видам животных и растительных организмов. Разбавленные растворы сульфата гидразина губительно действуют на семена, морские водоросли, одноклеточные и простейшие организмы. У млекопитающих гидразин вызывает судороги. В животный организм гидразин и его производные могут проникать любыми путями: при вдыхании паров продукта, через кожу, через пищеварительный тракт.
Для человека степень токсичности гидразина не определена. По расчетам S. Krop, опасной концентрацией следует считать 0,4 мг/л. Ch. Comstock с сотрудниками полагает, что предельно допустимая концентрация не должна превышать 0,006 мг/л. Согласно более поздним американским данным, эта концентрация при 8-часовой экспозиции снижена до 0,0013 мг/л. Важно отметить при этом, что порог обонятельного ощущения гидразина человеком значительно превышает указанные числа и равен 0,014—0,030 мг/л. Существенным в этой связи является и тот факт, что характерный запах ряда гидразинопроизводных ощущается лишь в первые минуты контакта с ними. В дальнейшем вследствие адаптации органов обоняния, это ощущение исчезает, и человек, не замечая того, может длительное время находиться в зараженной атмосфере, содержащей токсические концентрации названного вещества.
Несимметричный диметилгидразин (НДМГ, «гептил», 1,1-диметилгидразин) — компонент высококипящего (имеющего температуру кипения выше 0 °C) ракетного топлива. В качестве окислителя в паре с НДМГ часто применяется тетраоксид азота (АТ), чистый или в смеси с азотной кислотой, известны случаи применения чистой кислоты и жидкого кислорода. Для улучшения свойств может использоваться в смеси с гидразином, известной как Аэрозин.
Широко применяется в ракетной технике. В частности, на российской РН «Протон», российско-украинских РН «Днепр», «Космос», украинской РН «Циклон»; американских — семейства «Титан»; французских — семейства «Ариан»; в двигательных установках пилотируемых кораблей, спутников, орбитальных и межпланетных станций, а также некоторых баллистических ракет.
НДМГ — бесцветная или слегка желтоватая прозрачная жидкость с резким неприятным запахом, характерным для аминов (запах гниющей рыбы с примесью аммиака). Температура кипения +63 °C, температура кристаллизации -57 °C, плотность 790 кг/м2. Хорошо смешивается с водой, этанолом, большинством нефтепродуктов и многими органическими растворителями. Гигроскопичен, поглощает влагу из воздуха.
Самовоспламеняется при контакте с окислителями на основе азотной кислоты и тетраоксида азота, что упрощает конструкцию и обеспечивает легкий запуск и возможность многократного включения ракетных двигателей.Взаимодействие НДМГ и его водных растворов с азотной кислотой протекает бурно. Воспламенение происходит до 50 %-й концентрации водного раствора. Растворы меньшей концентрации реагируют с образованием соли азотной кислоты. НДМГ термически стабилен до 350 °C. В интервале 350—1000 °C продуктами разложения являются аммиак, амины, синильная кислота, водород, азот, метан, этан, смолистые и другие вещества.
Обладает сильным токсическим и мутагенным действием (например, он в четыре раза токсичнее синильной кислоты). К преимуществам пары НДМГ+АТ, что обеспечивает их широкое применение, относятся:превосходит пару кислород+керосин и пару кислород+водород по плотности, большая взрывобезопасность по сравнению с парой водород+кислород, самовоспламеняемость при контакте топливных компонентов, возможность длительного хранения в заправленном виде при нормальных температурах. К недостаткам НДМГ+АТ относятся: чрезвычайно высокая токсичность, канцерогенность даже в субтоксичных концентрациях, вероятность взрыва НДМГ в присутствии окислителя, меньший удельный импульс, чем у кислородно-керосиновой пары, цена НДМГ заметно выше цены керосина, что существенно для больших ракет.
Гидразинные горючие отличаются низкой химической стабильностью в контакте с атмосферой, однако практически не вызывают коррозии конструкционных материалов в паровой и жидкой фазах. Для хранения НДМГ используют резервуары из малоуглеродистых сталей, установленные наземно или заглубленно. Так же, как и тетраоксид азота, НДМГ хранят под давлением азота в насыщенном состоянии.Транспортирование НДМГ осуществляют в основном железнодорожным и автотранспортом. Авиационные и водные перевозки в России крайне редки.Гидразинные горючие транспортируют в железнодорожных и автомобильных цистернах в больших объемах по всей территории РФ. Для исключения контакта горючего с атмосферой в железнодорожных и автомобильных цистернах поддерживается избыточное давление азота 100—150 кПа.
 2015-05-30
2015-05-30 2876
2876








