Токсический процесс проявляется на всех уровнях организации биологических объектов (рис. 8).
На клеточном уровне возникают:
- обратимые структурно-функциональные изменения (изменение формы, сродства к красителям, подвижности и т.д.);
- преждевременная гибель клетки (некроз, апоптоз);
- мутации (генотоксичность).
Неспецифическое повреждающее действие химических соединений на отдельные органы и системы, а также развитие интоксикации по принципу «избирательной токсичности» проявляется:
- функциональными реакциями (бронхоспазм, лейкоцитоз, усиление диуреза, кратковременное падение артериального давления и т.д.);
- заболеваниями органа;
- неопластическими процессами;
- гибелью органа.
На организменном уровне токсический процесс проявляется:
- болезнями химической этиологии (интоксикации, отравления);
- транзиторными токсическими реакциями – самопроизвольно преходящими состояниями, сопровождающимися кратковременной утратой дееспособности (раздражение слизистой глаз, дыхательного и пищеварительного тракта, седативно-гипнотические, психодислептические состояния и т.д.);
- специальными токсическими процессами, развивающимися лишь у части пораженных, как правило, при наличии дополнительных условий (сочетанное воздействие токсикантов, определенный период жизнедеятельности организма и т.д.) и характеризующимися длительным скрытым периодом – канцерогенез, эмбриотоксичность, нарушение репродуктивных функций;
- аллобиозом – стойкими изменениями реактивности организма на воздействие химических, физических и биологических факторов внешней среды, а также психические и физические нагрузки (аллергия, иммуносупрессия, повышенная утомляемость и т.д.).
Токсическое действие веществ на популяционном уровне в настоящее время рассматривается как экотоксическое и проявляется:
- ростом заболеваемости, смертности, уменьшением рождаемости, числа врожденных аномалий развития;
- нарушением демографических характеристик популяции (соотношение возрастов, полов и т.д.);
- снижением средней продолжительности жизни членов популяции.
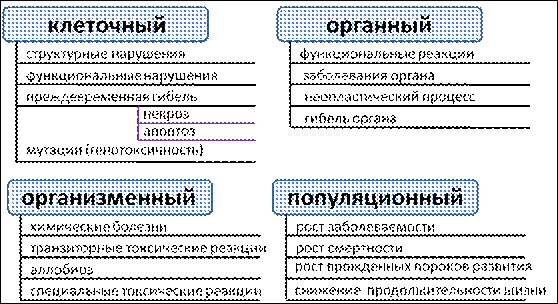
Рис. 8 – Основные проявления токсического процесса на различных уровнях организации биологических объектов
Токсичность различных химических соединений зависит как от свойств токсиканта, так и биосистемы и в конечном итоге определяется:
1. Способностью вещества достичь структуры-мишени, взаимодействие с которой инициирует токсический процесс.
2. Характером и прочностью связи, образующейся при взаимодействии токсиканта и структуры-мишени (табл. 8).
Образующийся комплекс тем прочнее, чем выше энергия связи, а также чем более комплиментарна молекула токсиканта рецептору.
3. Значением структуры-мишени для поддержания гомеостаза в организме.
В общем смысле под термином «рецептор» или «мишень» в токсикологии понимают структурный элемент биологической системы, с которым вступает в химическое взаимодействие токсикант.
Таблица 8 – Типы связей между токсикантом и структурой-мишенью
| Вид связи | Энергия связи (кДж/моль) |
| ионная | |
| ковалентная | 40-600 |
| донорно-акцепторная | 4-20 |
| ион-дипольная | 8-20 |
| диполь-дипольная | 4-12 |
| водородная | 4-28 |
| Ван-дер-Ваальса | 1-4 |
| гидрофобная | 1-6 |
Мишенями (рецепторами) для токсического воздействия могут быть:
- структурные элементы межклеточного пространства;
- структурные элементы клеток организма;
- структурные элементы систем регуляции клеточной активности.
К числу общих механизмов, лежащих основе цитотоксичности, можно отнести следующие:
- нарушение энергетического обмена;
- нарушение гомеостаза внутриклеточного кальция;
- активация свободно-радикальных процессов в клетке;
- нарушение процессов синтеза белка и клеточного деления;
- повреждение клеточных мембран.
Следует отметить, что все вышеперечисленные механизмы тесно взаимосвязаны друг с другом, и каждый из них зачастую является пусковым для следующего, тем самым формируя т.н. «порочный круг».
Жизнь клеток и макроорганизмов сопровождается постоянным синтезом сложных кислот (белков, нуклеиновых кислот, полисахаридов, липидов и др.), характеризующихся высокой степенью энтальпии (энергосодержания) и низкой энтропией (степенью неупорядоченности системы). Образование таких молекул требует увеличения свободной энергии системы. Энергетические возможности клетки определяются запасами макроэргов, в первую очередь АТФ. Синтез АТФ протекает за счет двух тесно взаимосвязанных процессов: гликолиза, осуществляемого в цитоплазме клеток, и биологического окисления субстратов, протекающего в митохондриях.
Наиболее уязвимыми для действия токсикантов элементами биологической системы, обеспечивающей образование макроэргов в организме, являются:
- механизмы биологического окисления (ферменты цикла трикарбоновых кислот, дыхательной цепи);
- механизмы сопряжения биологического окисления и фосфорилирования (синтез АТФ из АДФ и фосфата);
- механизмы доставки кислорода к клеткам кровью.
Нарушение внутриклеточного гомеостаза кальция, лежащее в основе механизма клеточной гибели при целом ряде патологических состояний, таких, как ишемия, аутоиммунные процессы и др., чаще всего является следствием:
- повреждения биологических мембран и усиления их проницаемости для ионов;
- нарушения биоэнергетики клетки, приводящего к истощению запасов макроэргов;
- изменения функционального состояния белковых комплексов (в т.ч. и путем воздействия на определенные рецепторы), образующих каналы для Сa2+.
Цитотоксический эффект в результате стойкого повышения содержания Сa2+ в цитоплазме связывают с развивающимся при этом повреждением целостности цитоскелета и неконтролируемой активацией катабоических энзимов (фосфолипаз, протеаз, эндонуклеаз).
Интегральным эффектом запуска некоторыми токсикантами каскада радикал-инициирующих реакций является значительное нарушение физиологии клетки, а также ее целостности, проявляющееся на микроскопическом уровне некрозом ткани с ее последующей организацией, а в отдаленный период – неопластическими процессами.
Цитоплазматические мембраны служат организующим звеном для компартментализации различных энзиматических систем. Складчатость мембран способствуем увеличению площади их поверхности и, тем самым, интенсификации обменных процессов. Токсическое действие многих веществ сопряжено с прямой или опосредованной дезорганизацией мембранных структур. Наиболее вероятными механизмами опосредованного повреждения биологических мембран при интоксикациях являются:
- активация перекисного окисления липидов;
- активация фосфолипазной активности.
При непосредственном воздействии токсикантов на липидный бислой или белковые компоненты мембранных комплексов могут развиваться неспецифические, полуспецифические и строго специфические эффекты. При этом токсический эффект проявляется изменением следующих параметров биомембран:
- проницаемость;
- заряд;
- нарушение процессов синтеза белка и клеточного деления.
Говоря об общих механизмах действия ядов, американские исследователи Грин и Гольдберг (1968) выделяют 2 их типа. К первому относятся вещества, обладающие способностью реагировать со многими компонентами клетки и в молекулярном плане, по образному выражению авторов, «такие яды напоминают слона в посудной лавке». Поскольку избирательность их действия мала, то сравнительно большое число молекул расходуется на взаимодействие со множеством второстепенных клеточных элементов, прежде, чем яд в достаточном количестве подействует на жизненно важные структуры организма, а соответственно проявится его токсический эффект. Так, например, действуют хлорэтиламины.
Яды второго типа реагируют только с одним определенным компонентом клетки, не расходуясь на «несущественные» взаимодействия, и поражают одну определенную мишень. Очевидно, что представители второй группы токсикантов способны вызвать отравлениях в гораздо более низких концентрациях. Ярким примером такого рода веществ является синильная кислота.
Острые отравления целесообразно рассматривать как «химическую травму», развивающуюся вследствие внедрения в организм токсической дозы чужеродного химического вещества. Если представить процесс взаимодействия организма с химическими веществами как эшелонированную оборону (рис. 9), то прослеживаются 3 ее линии: жизни, борьбы и смерти.
На первой линии обороны показатели дыхания и кровообращения не выходят за пределы т.н. «нормы патологии» - уровня, характерного для типовой реакции при химическом стрессе и дистрессе.
На второй линии отмечается расстройство адаптации кариореспираторной системы к химической травме: отмечается выраженное тахипноэ, уровень снижения артериального давления соответствует клинической картине экзотоксического шока или интоксикационного коллапса.
Третья линия обороны соответствует развитию терминального состояния, которое может сопровождаться как обратимыми, так и необратимыми нарушениями функции, а впоследствии и структурных изменений жизненно важных систем органов.
Стресс – это типовая физиологическая реакция организма на любую экстремальную ситуацию, тогда как дистресс (его также называют тяжелым стрессом) представляет собой патологическую форму такой реакции.
Неспецифическое напряжение приспособительных систем организма, т.н. общий адаптационный синдром, впервые был описан г.Селье в 1936 г. на модели интоксикации формалином в виде трех основных проявлений:
- увеличение массы коркового слоя надпочечников с уменьшением количества секреторных гранул в клетках;
- уменьшение массы иммунокомпетентных органов (тимуса, селезенки) с одновременным снижением уровня иммунокомпетентных клеток в периферической крови;
- появление острых эрозий и язв гастродуоденальной зоны.
Г.Селье называл дистресс горем, несчастьем для человека, пережившего экстремальную ситуацию, и призывал к жизни со стрессом, но без дистресса.
Таким образом, в своей совокупности синдромы стресса и дистресса, шока и коллапса, а также периоды обратимых и необратимых терминальных состояний представляют универсальный неспецифический фазовый патологический процесс, развивающийся в организме в ответ на любое экстремальное воздействие, в т.ч. и на экзогенную интоксикацию. В зависимости от уровня обороны, задействованного при неспецифическом ответе на экзогенную интоксикацию, с большой долей вероятности можно утверждать, что легкой степени интоксикации соответствует состояние химического стресса, токсическому поражению средней степени тяжести – химического дистресса (или тяжелого стресса), а развитие экзотоксического шока или интоксикационного коллапса соответствует тяжелой степени интоксикации.
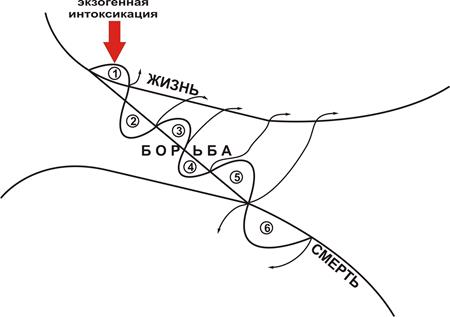
Рис. 9 – Развитие неспецифического экстремального патологического процесса при экзогенных интоксикациях (по Сосюкину и др., 2002):
1 – химический стресс 2 – дистресс
3 – экзотоксический шок при управляемой гипотензии
4 – экзотоксический шок при неуправляемой гипотензии
5 – терминальное состояние (обратимые изменения)
6 – терминальное состояние (необратимые изменения)
Общий эффект токсиканта является результатом специфического токсического действия, проявляющегося в ранней стадии острых отравлений – токсикогенной, и обусловленного высокой дозой токсического агента в организме, и неспецифических реакций организма – соматогенного действия.
Основными висцеральными синдромами при экзогенных интоксикациях являются: токсическая кома, токсический отек легких, кардиотоксический синдром, гемотоксическая и гистотоксическая гипоксия токсическая гепато- и нефропатия. Следует отметить, что в токсикогенную фазу активируются защитные механизмы, лишенные «химической специфичности»: «централизация» кровообращения, гипофизарно-адреналовая реакция (стресс-реакция), гипокоагуляция и фибринолиз и др., которые часто переходят в патологические, а в ряде случаев в течении и прогнозе интоксикации играют большую роль, чем специфическое действие яда.
Развитие клиники острого отравления определяется тремя основными факторами: пространственным, временным и концентрационным (рис. 10).
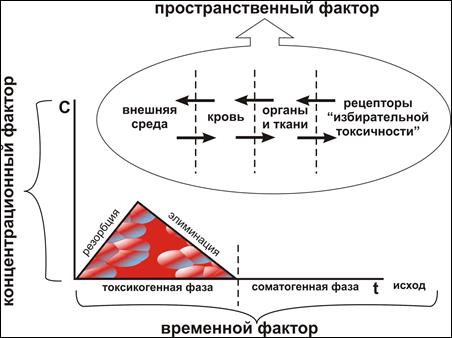
Рис. 10 – Основные факторы, определяющие развитие острого отравления
Пространственный фактор определяет пути поступления и распространения яда в организме, при этом наиболее распространен пероральный (алиментарный) путь поступления, являющийся по данным ряда авторов основным в 95% случаев острых интоксикаций.
Помимо физико-химических свойств самого токсиканта на скорость его всасывания из желудочно-кишечного тракта наибольшее влияние оказывают:
- различные значения рН на протяжении пищеварительного тракта;
- количественный и качественный состав химуса;
- интенсивность интрамурального кровотока;
- характер перистальтики;
- интенсивность секреции слизи, желудочного сока и др.
Всасывание ядовитых веществ происходит в 20-30% в желудке и в 70-80% - в тонком кишечнике, секрет которого имеет рН 7,5-8,0. В общей форме барьер «кишечная среда – кровь» имеет вид: эпителий-мембрана эпителия со стороны капилляра-базальная мембрана капилляра (рис. 11).

Рис. 11 – Схематичное строение гематоинтестинального барьера
I – химус; II – нерастворимый слой слизи, слизисто-щелочной барьер;
III – эпителий; IV – базальная мембрана эпителия; V – просвет капилляра;
VI – кровеносный капилляр; VII - эритроциты
Всасывание подразделяется на фазы быстрой и медленной резорбции. Фаза быстрой резорбции продолжается 30-40 мин., медленной – от 6 часов до нескольких суток.
Поступление токсикантов из просвета кишечной трубки в кровеносное русло возможно различными способами:
- пассивная диффузия через мембрану клеток, определяющаяся градиентом концентрации химических веществ;
- фильтрация через поры мембран, зависящая от гидростатического и осмотического давления;
- активный транспорт против градиента концентрации;
- пиноцитоз.
Так, тяжелые металлы непосредственно повреждают эпителий, липофильные вещества хорошо всасываются путем диффузии, а всасывание электролитов определяется степенью их ионизации (быстро резорбируются основания – атропин, хинин, анилин и др.). Отравляющие вещества, близкие по строению к природным соединениям, всасываются путем пиноцитоза в области микроворсинок щеточной каемки тонкой кишки. Трудно всасываются прочные комплексы токсических веществ с белками.
Замедление регионарного кровотока и депонирование венозной крови в кишечнике при экзотоксическом шоке приводит к уравниванию локальных концентрации ядов в интрамуральных кровеносных сосудах и в содержимом кишечника. При этом происходит замедление всасывания и увеличение местного токсического действия, что подтверждает необходимость тщательного очищения желудочно-кишечного тракта (ЖКТ) не только при раннем, но и при позднем поступлении пациента.
Наиболее быстрое поступление токсиканта в кровь происходит при ингаляционном отравлении, что обусловлено большой поверхностью всасывания легочных альвеол (100-150 м2), малой толщиной альвеолярных мембран, интенсивным током крови по легочным капиллярам и отсутствием условий для депонирования яда.
Структуру барьера между воздухом и кровью можно схематически представить в следующем виде: липидная пленка, мукоидная пленка, слой альвеолярных клеток, базальная мембрана эпителия, сливающаяся с базальной мембраной капилляра (рис. 12).
Всасывание летучих соединений во всех отделах дыхательных путей происходит по закону диффузии в соответствии с градиентом концентрации. На скорость всасывания влияют физико-химические свойства вещества (в первую очередь коэффициент Оствальда, характеризующий растворимость токсиканта в воде) и, в меньшей степени, состоянием организма (интенсивность дыхания и кровообращения в легких).
При попадании токсиканта в дыхательные пути активируются защитные процессы. В верхних дыхательных путях происходит задержка 80-90% частиц величиной до 10 мкм, в альвеолярную область поступает 70-90% частиц размером до 1-2 мкм. В процессе самоочищения дыхательных путей токсикант удаляется вместе с мокротой посредством кашлевого рефлекса и акта чихания, при этом значительная его часть может попасть в желудок со слюной.
Существенную роль в очищении альвеолярной области играют макрофаги и лимфатическая система.
Рис. 12 – Схематическое строение аэрогематического барьера
1 – сурфактант; 2 – альвеолярный эпителий; 3 – интерстициальной пространство;
4 – плазма; 5 – эндотелий капилляра; 6 – эритроцит
Для ряда токсикантов существенное значение имеет перкутанный путь поступления. Существует 3 варианта поступления яда через кожный покров: через эпидермис, через волосяной фолликул и через выводные протоки сальных и потовых желез (рис. 13). Эпидермис рассматривается как липопротеиновый барьер, через который могут диффундировать разнообразные газы и органические вещества в количестве, пропорциональном их коэффициентам распределения липиды/вода.
Механические повреждения кожи (ссадины, царапины, раны и т.д.), а также термические и химические ожоги значительно облегчают проникновение токсиканта в организм.
Второй составляющей пространственного фактора является распределение токсиканта в организме (рис. 14). Последнее во многом связано с кровообращением органов и тканей, поскольку количество яда, поступающего к органу, зависит от его объемного кровотока, отнесенного к единице массы тканей (рис. 15), а также суммарной площади капиллярного русла ткани. Исходя из вышесказанного, наибольшее количество яда в единицу времени поступает в легкие, почки, печень, сердце и мозг. При ингаляционных отравлениях основная часть яда поступает в почки, а при пероральных – в печень, т.к. соотношение удельного кровотока печень/почки составляет примерно 1:2.
Существуют различные способы транспортировки ядов в кровеносном русле. Для многих токсикантов характерно связывание с белками плазмы, преимущественно с альбуминами. Вид связи определяется сродством данного соединения к белкам и осуществляется ионными, водородными и ван-дер-ваальсовыми силами. Некоторые токсичные соединения транспортируются с клетками крови, преимущественно с эритроцитами (мышьяк, свинец и др.).
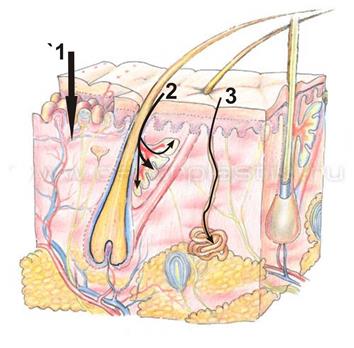
Рис. 13 – Схема поступления токсикантов через кожу
1 – через эпидермис; 2 – через волосяной фолликул и потовую железу;
3 – через сальную железу
Токсиканты-неэлектролиты частично растворяются в жидкой части крови, а частично проникают в эритроциты, где чаще всего сорбируются на молекуле гемоглобина.
Одним из основных токсикологических показателей является объем распределения токсиканта, который в организме человека представлен тремя секторами: внеклеточной жидкостью (около 14 л), внутриклеточной жидкостью (около 28 л) и жировой тканью, объем которой может варьировать в широких пределах. Водорастворимые яды способна накапливаться во всем водном секторе организма, а липофильные депонируются преимущественно в жировой ткани. Для анализа распределения токсикантов в организме достаточно рассмотреть максимально упрощенную двухмерную модель (рис. 16).
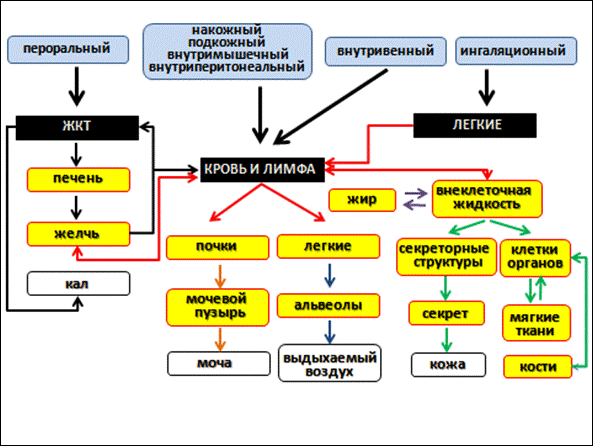
Рис. 14 – Общая пространственная схема движения ядов в организме
Камера V1 всю внеклеточную жидкость с концентрацией вещества С, что соответствует уровню препарата в крови. Камера V2 содержит внутриклеточную жидкость с концентрацией токсического вещества kC, где k – коэффициент пропорциональности, определяющий степень сродства ткани к токсиканту. В количественном соотношении это сродство может варьировать в весьма широких пределах. Так, например, концентрация акрихина в ядрах гепатоцитов после достижения равновесия в смеси клеток в 200 раз превышала таковую в других органеллах. Вышеуказанный коэффициент для уточнения внутриклеточной концентрации токсиканта является весьма условным и его применение оправдано при условии, что процессы поступления и элиминации яда из организма происходят во времени, на порядок большим, чем время полной циркуляции крови.
Основной задачей клинической токсикологии является определение общей дозы циркулирующего яда по его концентрации в плазме крови, что подразумевает наличие сведений об объеме распределения токсиканта. При этом следует иметь в виду, что при отравлении веществом, распределяющимся только во внеклеточной жидкости (т.е. в 14 л), элиминация этого сектора организма происходит быстрее, чем в случае интоксикации ОВ, распределяющимся как внеклеточно, так и внутриклеточно (т.е. в объеме 42 л).
Таким образом, объем распределения является весьма важным показателем, позволяющим сопоставить скорость элиминации токсиканта с градиентом снижения его концентрации в плазме крови и решить вопрос, поступают ли новые дозы яда в кровоток (извне, из ЖКТ и т.д.). Объем распределения является весьма условной величиной, поэтому в расчетах коэффициент связи яда с тканевыми структурами (К) можно опустить, т.к. для большинства клеток он неизвестен, и при анализе распределения токсиканта исходить из условий простой однокамерной модели.

Рис. 15 – Интенсивность кровоснабжения различных органов и тканей
Судьба токсиканта, поступившего в организм из желудочно-кишечного тракта и распределяющегося в двухкамерной системе, может быть представлена в виде направленных потоков:
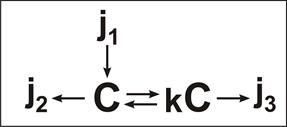
где J1 – поток вещества, всасывающегося из желудка, J2 – поток экскреции, J3 – условный поток утилизации токсиканта в тканях (метаболическое превращение, С – концентрация вещества в плазме, k – коэффициент связывания вещества с белками сектора V2.
Кроме вышеупомянутых, следует учитывать также и другие факторы, влияющие на утилизацию и распределение токсиканта: физиологические особенности, возраст, пол, биоритмы, наличие сопутствующей патологии и др.
Очищение организма от чужеродных веществ включает различные механизмы, которые суммарно предопределяют «тотальный клиренс», включающий триосновных направления детоксикации: метаболическое превращение (биотрансформация), почечная экскреция и внепочечное очищение (рис. 17).
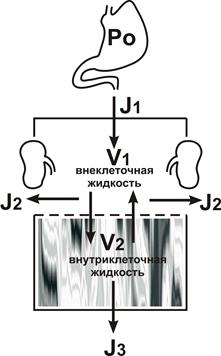
Рис. 16 – Двухкамерная модель распределения токсикантов в организме
Ро – общая доза яда, введенная в организм, остальные обозначения – как в схеме, приведенной выше
Метаболические превращения занимают особое место в детоксикации чужеродных веществ, поскольку они являются как бы «подготовительным» этапом для их удаления из организма. Биотрансформация идет по 2 направлениям: метаболические реакции разложения (окисление, восстановление, гидролиз), протекающие с затратой энергии, и реакции синтеза (соединение с белками, аминокислотами, глюкуроновой и серной кислотами), не требующие использования энергетических ресурсов. Общий физиологический смыслы вышеупомянутых превращений заключается в образовании нетоксичных гидрофильных соединений, которые гораздо легче, чем исходное вещество, могут вовлекаться в другие метаболические превращения и выводиться экскреторными органами из организма.
Простейший цикл заключается в следующем: попавшие в организм токсиканты (RH) соединяются с альбумином (А) и в виде комплекса (RHA) транспортируются в печень. Часть из них может попадать в печень и в свободном виде. Здесь на цитохроме Р-450 в мембранах эндоплазматического ретикулума гепатоцита происходит окисление ксенобиотика, который уже в виде нового комплекса (ROHA) или в свободном виде (ОН) удаляется через экскреторные органы.
Следует отметить, что в ряде случаев токсикант включается в метаболические процессы, в результате которых нетоксичное или малотоксичное вещество превращается в высокотоксичное соединение. Такое явление называется летальным синтезом.
Ярким примером летального синтеза является метаболизм метилового спирта, токсичность которого полностью определяется продуктами его окисления – формальдегилом и муравьиной кислотой:
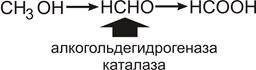
Пути и способы естественного выведения токсикантов из организма различны. По практическому значению они располагаются следующим образом: почки – кишечник – легкие – кожа.
Главной ферментативной реакцией детоксикации в печени является окисление ксенобиотиков на цитохроме Р-450 (рис. 18).
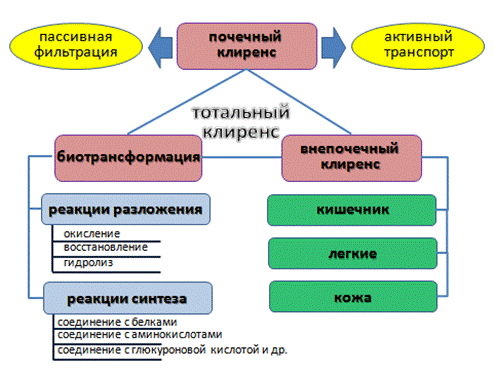
Рис. 17 – Основные механизмы «тотального клиренса» токсикантов
Если включено несколько путей экскреции, то тотальный клиренс (L) составляет их сумма. Выделение токсических веществ через почки осуществляется посредством пассивной фильтрации и активного транспорта.
Через кишечник с калом удаляются:
- вещества, не всосавшиеся в кровь при пероральном поступлении;
- вещества, выделенные из печени с желчью;
- вещества, поступившие в кишечник через мембраны его стенки.
Многие неэлектролиты, подвергаясь в организме медленной биотрансформации, выделяются в виде основных продуктов распада – воды и углекислого газа, который элиминируется с выдыхаемым воздухом.
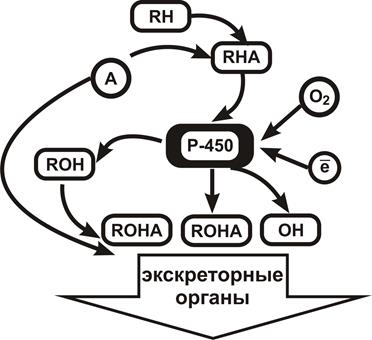
Рис. 18 – Механизм окисления гидрофобных токсикантов цитохромом
 2015-05-30
2015-05-30 4547
4547
