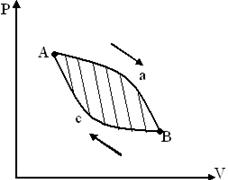
Это справедливо для любого обратимого кругового процессе (рис.35).
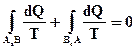 (73)
(73)
или 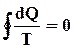 (74)
(74)
Следовательно, 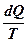 полный дифференциал некоторой функции S, зависящей только от состояния системы
полный дифференциал некоторой функции S, зависящей только от состояния системы
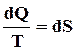 . (75)
. (75)
Рис.35
Функция S – энтропия
Ее свойства:
1. Энтропия системы, состоящей из нескольких тел равна сумме энтропий этих тел.
2. При обратимых процессах энтропия системы неизменна, а при необратимых – возрастает.
3. Энтропия изолированной системы, не может уменьшаться ни при каких процессах.
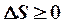 - неравенство Клаузиуса
- неравенство Клаузиуса
Энтропия – мера неупорядоченности системы или мера обесцененности энергии.
3-е начало термодинамики – закон Нернста (если Т=0, то S=0).
При абсолютном нуле температуры энтропия равна нулю.
Как следует из теоремы Пригожина при стационарном состоянии системы внутренние неравновесные процессы протекают в соответствии с градиентом температуры, концентрации, электрического потенциала и т.п., создающих соответственно потоки тепла, вещества, электрических зарядов и т.д. Неравновесные процессы неизбежно должны увеличивать энтропию системы. Однако живой организм является открытой системой и взаимодействует с внешней средой и, поэтому, в процессе роста энтропия либо неизменна, либо уменьшается.
Из внешнего мира с пищевым рационом живые организмы получают отрицательную энтропию в форме организованных структур – мономеров и химической энергии пищевых продуктов.
Энергетическое состояние любой системы характеризуется термодинамическими потенциалами:
- внутренней энергией – U=Q-A;
- энтальпией - H=U+PV;
- потенциалом Гиббса - ∆G=U-TS+PV (энергия, которую можно превратить в работу);
- потенциалом Гельмгольца - F=U-T∆S (внутренняя энергия без энтропии).
При неизменных объемах потенциалы Гиббса и Гельмгольца равны.
Живые организмы не находятся в состоянии термодинамического равновесия. Динамика изменения энтропии определяет направленность эволюции открытых систем. Спонтанное образование под действием солнечной энергии более сложных систем означает уменьшение энтропии в открытых системах.
Вопросы для самоконтроля
1. Что называется термодинамическим процессом?
2. Как формулируется первое начало термодинамики?
3. Как выражается работа при изменении объема газа?
4. Какой процесс называется адиабатическим?
5. Как изменяется температура газа при его адиабат. расширении и сжатии?
6. Почему адиабата круче изотермы?
7. Что называется циклическим процессом?
8. Что выражает уравнение Пуассона?
9. Сформулируйте второе начало термодинамики.
10. Идеальная тепловая машина и ее коэффициент полезного действия.
11. Что выражает энтропия и каковы ее свойства?
СПИСОК ЛИТЕРАТУРЫ
 2015-05-30
2015-05-30 629
629








