2.1. По кривым охлаждения сплавов Cd – Bi: 1. построить диаграмму состояния этой системы; 2. определить состав эвтектической смеси; 3. Рассчитать, сколько килограммов и какой компонент выпадает из 3 кг жидкого расплава, содержащего 20 % висмута, если расплав охладить до 200°С; 4. определить при этой температуре состав жидкой фазы.
РЕШЕНИЕ:
1. Построение диаграммы приведено на рис. 1. Из каждой точки излома на кривых охлаждения проводят прямую, параллельную оси абсцисс, и из точки указывающей состав сплава на оси концентраций, восстанавливают перпендикуляр до пересечения с первой прямой. Пересечение их, найденное для первого сплава дает первую точку фазовой диаграммы. Таким же способом находят точки для второго сплава и т.п. Второй излом на кривых охлаждения, кроме кривых чистых компонентов, дает температуру затвердевания эвтектики;
2. Для определения состава эвтектики соединяют полученные точки кривыми, которые продолжают до пересечения их с прямой, проходящей при температуре затвердения эвтектики (АВ). Точка пересечения, как видно из диаграммы, соответствует 60 % висмута. Следовательно, эвтектика имеет состав: 60% висмута и 40 % кадмия;
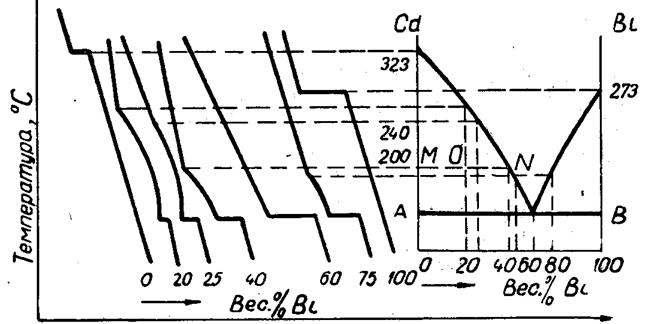
Рис. 1. Схема построения диаграммы состояния по данным термического анализа.
3. На диаграмме находим точку, соответствующую составу 20% висмута и температуре 200°С. Для этого восстанавливаем перпендикуляр из точки на оси концентрации соответствующей содержанию висмута 20%, до пересечения с прямой, проходящей при температуре 200°С (точка 0). Т.к. точка 0 лежит в двухфазной области состоящей из жидкого расплава и твердых кристаллов кадмия, то, следовательно, при заданных температуре и концентрации, кадмий будет выпадать из расплава. Количество выпавшего кадмия определяют по правилу рычага. Измеряем длины отрезков ОМ и ОN. Пусть первый равен 10 мм, а во второй - 17 мм. Тогда количество кадмия, выпавшего из расплава, при общем весе расплава 3 кг будет равно
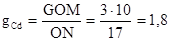 кг
кг
4.Для определения состава жидкой фазы при температуре 200°С опускаем из точки N перпендикуляр на ось концентраций и находим на этой оси, таким образом, состав жидкой фазы при заданной температуре. В нашем случае состав соответствует концентрации приблизительно 45 % висмута.
2.2. Раствор NH4HCO3 60% -й (масс.) охлаждают от 100 до 20° С.
Используя рис. 2, определите:
1. Характеристики исходного фазового состояния системы;
2. Характеристики ее конечного фазового состояния;
3. Какое вещества и в каком количестве выпадает в осадок при охлаждении системы;
4. При какой температуре начинается кристаллизация системы;
5. Какова конечная концентрация раствора.
РЕШЕНИЕ:
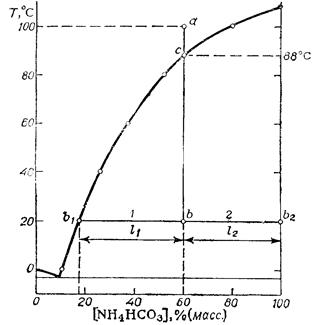
Для всех рассматриваемых случаев общим является то, что число независимых компонентов системы равно двум: К = 2, т.к. она во всех случаях состоит из двух компонентов - NH4HCO3 и H2O, не связанных между собой никакими видами взаимодействия. Кроме того, в рассматриваемой системе нет газообразной фазы, следовательно эта система конденсированная - n = 1 и все расчеты надо вести по формуле С = К + 1 – Ф
1) По пересечению изотермы 100°С с линией концентрации 60% (масс.) найдем на диаграмме точку а, отображающую исходное фазовое состояние рассматриваемой системы. Она расположена над линией ликвидуса. Это значит что в данном состоянии система жидкая, следовательно, число ее фаз в этом состоянии равно единице (Ф=1).
Подставим соответствующие данные в формулу (см. выше), рассчитываем число степеней свободы системы: С= 2+1-1=2
Действительно, в состоянии отображенном на фазовой диаграмме точкой а, допускается произвольное изменение температуры и состава системы без нарушения при этом ее гомогенности. Лишь при значительном понижении температуры и увеличения содержания NH4HCO3 произойдет нарушение гомогенной системы - состояние переместиться в область, расположенную под линией ликвидуса.
2) Из точки а опускаем перпендикуляр до пересечения с изотермой 20°С. Точка пересечения в будет отображать конечное фазовое состояние системы. Здесь при пересечении линии ликвидуса в системе появляется кристаллическая фаза и число фаз остается равным двум (Ф=2). Это кристаллы NH4HCO3 и раствор, насыщенный NH4HCO3 при 20°С. Число степеней свободы системы в данном состоянии равно единице: С= 2+1-2=1
Это объясняется тем, что с появлением в системе второй фазы в действие вступает зависимость состава жидкой фазы (концентрация насыщенного раствора) от температуры, описываемая на фазовой диаграмме линией ликвидуса.
3) Проведем через точку в ноду. Своим левым концом нода опирается на линию ликвидуса (точка b1), а правая - на правую ось температур (точка b2), являющуюся в данном случае и линией солидуса. Приняв в качестве масштаба ось состава, имеем: длина правого плеча рычага l2=40ед., а длина левого l1=42ед.
Далее, приняв первоначальную массу раствора равной 1000 кг, по уравнению mтв / mж = l1 / l2, находим: mтв / (1-mтв) = 42/40 где mтв – масса осадка NH4HCO3 (искомая величина). Решив это выражение относительно mтв, получим: mтв = 0,512 х m = 512 кг NH4HCO3 .
4) Точка С пересечения перпендикуляра, опускаемого из точки а с линией ликвидуса характеризует появление в системе первых кристаллов NH4HCO3
Этой точке соответствует температура 88°С (определяется по изотерме, проходящей через точку С).
5) Концентрация раствора в конце процесса определяется по точке b1 на линии ликвидуса. Спроецировав эту точку на ось состава, находим: остаточное содержание NH4HCO3 в растворе 18 % (масс.).
2.3. Задача. По диаграмме плавкости системы Н2О - NH4Cl (см. рис. 3) ответить на следующие вопросы:
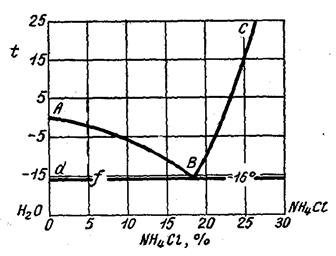
Рис. 3
1. Сколько NH4Cl содержалось в 750 г воды, если первые кристаллы льда появились при охлаждении раствора до - 10°С?
2. Что произойдет с кусочком льда, если его бросить при -5°С в 15 %-ый раствор NH4Cl?
3. Растворится ли кристалл NH4Cl в 25 %-ом растворе при + 10°С?
4. Какова растворимость NH4Cl в воде при +5° (растворимость выразить в молях соли на 1000 г воды)?
5. Сколько воды нужно добавить к 100 г 25- %-ного раствора NH4Cl охлажденного до - 10° С, чтобы выпавший NH4Cl вновь растворился?
6. Сколько эвтектики получится из 500 г 5 %-ного раствора NH4Cl?
РЕШЕНИЕ:
1. Как видно из диаграммы, при -10°С лед начинает выделяться из 14 %-ного раствора, следовательно, 750 г воды должны были составить 86 %. Отсюда искомое количество NH4Cl равно
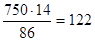 г
г
2. Лед расплавиться, т.к. точка, изображающая состояние системы, лежит в области, где устойчивой является одна жидкая фаза.
3. Кристалл NH4Cl не может раствориться в 25 %-ном растворе при +10°С, т.к. точка, изображающая состояние системы лежит в области, где устойчивыми являются две фазы: твердый NH4Cl и раствор.
4. Линия ВС диаграммы является линией растворимости NH4Cl в воде. Как видно из диаграммы, растворимость хлористого аммония при +5°С равна 23 %. Растворимость, выраженная в молях NH4Cl (Мr=53,3 г/моль) на 1000 г воды будет равна
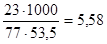 моль/л
моль/л
5. При -10°С растворимость NH4Cl равна 20 %. В 100 г 25 %-ного раствора содержится 25 г NH4Cl, который после разбавления должен составить 20 %. Тогда общий вес раствора после разбавления будет равен
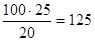 г
г
т.е. для растворения выпавшей соли нужно к взятым 100 г добавить 25 г воды.
6. По правилу рычага количество твердой фазы (тв), выделившейся к моменту достижения эвтектической температуры, относится к количеству оставшейся жидкости (ж), как отрезок fB к отрезку df, т.е.
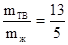
Общее количество твердой и жидкой фаз равно 500
mтв +mж = 500
 2015-06-04
2015-06-04 2261
2261
