ТЕМА 1
ФАЗОВЫЕ РАВНОВЕСИЯ. ФИЗИКО-ХИМИЧЕСКИЙ АНАЛИЗ.
1. Общие понятия. Правило фаз.
Фазовыми равновесиями называются равновесия, которые устанавливаются между отдельными фазами при физических процессах перехода веществ из одной фазы в другую. К числу таких переходов относятся плавление и кристаллизация индивидуальных веществ, кристаллизация веществ из растворов, испарение и сублимация, конденсация газообразных веществ, аллотропические превращения веществ, превращения ферромагнетика в парамагнетик и др.
Фазовые равновесия определяются соотношением термодинамических параметров (концентрация, t°, Р, напряженность магнитного поля, напряженность электрического поля) и описываются уравнением Клаузиуса – Клайперона и формулой Дж.Гиббса 1876 г.
С = К – Ф + n (1.1)
Эта формула получила название правила фаз. Она связывает число термодинамических степеней свободы, число независимых компонентов и число фаз системы.
Фазой называется однородная часть системы, обладающая одинаковыми интенсивными свойствами и отделенная от других частей системы поверхностью раздела.
Например, система из насыщенного раствора NaCl и монокристалла NaCl состоит из двух фаз. Если вместо монокристалла в системе будет порошок кристалликов NaCl, то все эти кристаллики вместе составят одну фазу, т.к. они представляют собой совокупность частей системы, одинаковых по всем интенсивным свойствам.
При фазовых переходах происходит выравнивание химических потенциалов. Например, если химический потенциал компонента в растворе выше, чем его химический потенциал в паре, то будет происходить испарение этого компонента из жидкого раствора, пока химические потенциалы не сравняются. В результате пар станет насыщенным, и в системе установится равновесие.
Число фаз в системе будем обозначать символом Ф.
Числом независимых компонентов К называется наименьшее число индивидуальных веществ в системе, достаточное для образования всех фаз данной системы. Их этого определения следует, что понятие «независимый компонент» не тождественно с понятием «индивидуальное вещество». Число независимых компонентов может совпадать и не совпадать с числом индивидуальных веществ.
Например, в трехфазной системе С6 Н 12 О6 (к) кристаллы сахара + насыщенный водный раствор + водяной пар имеется два индивидуальных вещества - вода и сахар и два независимых компонента 1 фаза - сахар, вторая - сахар + вода, третья - вода.
В системе, состоящей из трех индивидуальных веществ СаО, СаСО3, СО2 число независимых компонентов равно не трем а только двум (безразлично каким именно).
Выберем в качестве независимых компонентов СаО и СО2, тогда первая фаза образована СаО, вторая СаО и СО2, которые в результате реакции дают СаСО3, третья фаза - СО2.
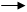 Система, состоящая из NH4Cl в смеси с NH3 + HCl в эквимолярных количествах, состоит из трех индивидуальных веществ, но только из одного независимого компонента - NH4Cl, достаточного для образования всех фаз данной системы (твердой фазы NH4Cl и газообразной, получаемой термическим разложением NH4Cl NH3 + HCl)
Система, состоящая из NH4Cl в смеси с NH3 + HCl в эквимолярных количествах, состоит из трех индивидуальных веществ, но только из одного независимого компонента - NH4Cl, достаточного для образования всех фаз данной системы (твердой фазы NH4Cl и газообразной, получаемой термическим разложением NH4Cl NH3 + HCl)
Т.о. число независимых компонентов К равно числу индивидуальных веществ минус число уравнений, связывающих эти вещества.
В примере первом К = 2 - 0 = 2, во втором К = 3 – 1 = 2, К = 3 – 2 = 1 в третьем (здесь вторым уравнение является условие [NH3] =[HCl]).
Число степеней свободы определяется как число условий (t°, Р, концентрация), которые можно произвольно менять (в известных пределах), не изменяя числа или вида фаз системы.
Сумма числа степеней свободы системы и числа фаз ее равна сумме независимых компонентов и числу внешних факторов, влияющих на равновесие этой системы:
С + Ф = К + n (1.2)
Если на систему воздействуют два фактора t°, Р, то правило фаз запишется в виде
С = К – Ф + 2 (1.3)
Число степеней свободы равновесной термодинамической системы, на которую из внешних факторов влияют только температура и давление, равно числу независимых компонентов системы минус число фаз плюс два.
Правило фаз показывает, что число степеней свободы возрастает с увеличением числа компонентов и уменьшается с увеличением числа фаз системы.
Число степеней свободы не может быть отрицательным, поэтому правило фаз нередко выражают так же следующим соотношением:
Ф <= К + 2 (1.4)
Число степеней свободы определяется как вариантность системы. По этому признаку - числу степеней свободы, системы разделяют на инвариантные или безвариантные (при С = 0), моновариантные или одновариантные (при С = 1), дивариантные или двухвариантные (при С = 2)… Поливариантными или многовариантными, называются системы с большим числом степеней свободы.
При К = 1 соотношение (1.3.) принимает вид: С = З – Ф. Т.к. число степеней свободы не может быть отрицательным, то в этом случае число фаз находящихся между собой в равновесии, не м.б. больше трех и, следовательно, здесь можно иметь только три типа систем: однофазные, двухфазные и трехфазные.
Для однофазных систем С = 2, для двухфазных С = 1 и для трехфазных С=0.
Диаграмма, выражающая зависимость состояния системы (и фазовых равновесий в ней) от внешних условий или от состава системы, называется диаграммой состояния или фазовой диаграммой.
Такие диаграммы строятся по соответствующим опытным данным и широко применяются для характеристики различных систем.
2.1. Диаграмма состояния воды
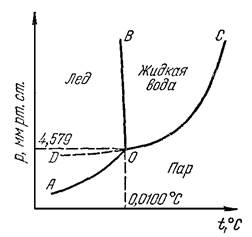
Рис. 1.1. Диаграмма состояния воды в области невысоких давлений.
ОД - продолжение кривой ОС.
Она определяет давление насыщенного пара над переохлажденной водой. Такое состояние неустойчиво и переохлажденная вода всегда обладает большим Рпара, чем лед при тех же условиях.
Кривая ОС представляет зависимость давления насыщенного пара жидкой воды от t°.
ОА - зависимость давления насыщенного пара от t°.
ОВ - зависимость температур замерзания воды от внешнего давления.
Эти три кривые разделяют диаграмму на поля, каждое из которых отвечает одному из агрегатных состояний - пару, жидкости, льду.
Сами кривые отвечают равновесию между соответствующими двумя фазами:
ОС - жидкость-пар
ОА - лед-пар
ОВ - лед-жидкость
Точка О характеризует условия равновесия одновременно между всеми тремя фазами - паром, льдом и жидкой водой.
Сами кривые отвечают равновесию между соответствующими двумя фазами.
Однофазные состояния воды обладают двумя степенями свободы. В этом случае мы можем изменять в определенных пределах как t°, так и Р (поля диаграммы) каждое независимо от изменений другого, что не вызывает изменения числа или вида фаз системы.
Двухфазные состояния воды представляются линиями, которые ограничивают соответствующие поля диаграммы. Число степеней свободы в этих случаях уменьшается до единицы (одновариантные системы). Не изменяя числа или вида фаз, можно изменять только t° или Р. При этом с изменением одного из этих параметров другой тоже не сохраняет прежнего значения, а изменяется в соответствии с изменением первого.
Точка О, называемая тройной точкой, отвечает равновесию одновременно между всеми тремя фазами. Число степеней свободы в этом случае равно нулю (система безвариантна). Существует только одно сочетание t° и Р, при котором рассматриваемые три фазы могут находится в равновесии.
2.2. Диаграмма состояния серы.
Сера может существовать в виде двух твердых модификаций - ромбической S(ромб) и моноклинной S(мон), жидкости S(ж) и газа S(г).
Сплошные линии аb, bс, сk, bd, сd и dе изображают на диаграмме устойчивые двухфазные равновесия:


 S(ромб) S(г) линия ab
S(ромб) S(г) линия ab

 S(мон) S(г) линия bc
S(мон) S(г) линия bc

 S(ж) S(г) линия ck
S(ж) S(г) линия ck
 S(ромб) S(мон) линия bd
S(ромб) S(мон) линия bd

 S(мон) S(ж) линия cd
S(мон) S(ж) линия cd

 S(ромб) S(ж) линия de
S(ромб) S(ж) линия de
Рис. 1.2. Диаграмма состояния серы.
Точки b, d, c являются тройными точками, которые изображают состояния устойчивых равновесий в трехфазной системе:
т. b Т=368,65 k, Р=0,496 Па


 S(ромб) S(мон) S(г)
S(ромб) S(мон) S(г)
т.с Т=392,45 k, Р=3,346 Па



 S(мон) S(ж) S(г)
S(мон) S(ж) S(г)
т.d Т=424,15 k, Р=1,305 х 10[А.Р.1] 8 Па


 S(ромб) S(мон) S(ж)
S(ромб) S(мон) S(ж)
Пунктирные линии bO, cO и dO соответствуют на диаграмме метастабильным двухфазным равновесиям:

 bO - S(ромб)(перегр). S(г) [пересыщенная относительно S(мон) ];
bO - S(ромб)(перегр). S(г) [пересыщенная относительно S(мон) ];

 cO - S(ж)(переохл). S(г) [пересыщенная относительно S(мон) ];
cO - S(ж)(переохл). S(г) [пересыщенная относительно S(мон) ];

 dO - S(ромб)(перегр). S(ж) [переохлажденная]
dO - S(ромб)(перегр). S(ж) [переохлажденная]
Линии bc, bd, cd и линии bO, cO, dO ограничивают области однофазной бивариантной системы:
Область bOd - перегретой S(ромб)
Область cOd - переохлажденной жидкой серы
область bOc - газообразной серы, пересыщенной относительно S(мон)
Точка О является тройной точкой и изображает на диаграмме неустойчивое метастабильное трехфазное равновесие:

 S(ромб)(перегр.) S(ж)(переохл.) S(г)(пересыщенная относительно S(мон)
S(ромб)(перегр.) S(ж)(переохл.) S(г)(пересыщенная относительно S(мон)
Жидкую серу можно переохладить до t° более низкой, чем t° метастабильной трехфазной системы (точка О). На диаграмме это изображено - ОО’, которой соответствует двухфазному метастабильному равновесию:

 S(ж)(переохл.) S(г)(пересыщенная относительно. S(мон) и S(ромб))
S(ж)(переохл.) S(г)(пересыщенная относительно. S(мон) и S(ромб))
Линия bb’ изображает двухфазное метастабильное равновесие:

 S(мон)(переохл.) S(г)(пересыщенная относительно S(ромб))
S(мон)(переохл.) S(г)(пересыщенная относительно S(ромб))
Двухкомпонентными системами являются сплавы двух различных металлов, солей, минералы, любой раствор, состоящий из растворителя и одного растворенного вещества.
По правилу фаз Гиббса в 2-х компонентной системе равновесие возможно при
| Число фаз | Правило фаз Гиббса С=К-Ф+2 |
| С=2-1+2=3 | |
| С=2-2+2=2 | |
| С=2-3+2=1 | |
| С=2-4+2=0 |
Из анализа 2-х компонентных систем по правилу фаз следуют такие заключения:
1) Наибольшее число фаз, находящихся в равновесии в 2-х компонентной системе равно 4. Это две твердые фазы I и II компонента, жидкая фаза и пар.
2) Наибольшее число степеней свободы в 2-х компонентой системе равно 3 - это t°, Р и концентрация одного из компонентов С.
Концентрация другого компонента величина зависимая и описывается уравнением:
С2 = 100% - С1
Т.о. полная диаграмма состояния 2-х компонентной системы должна строиться по трем пространственным осям - t°, Р и состав.
В большинстве случаев 2-х компонентные системы являются сконденсированными, т.е. состоят из жидкости и твердого вещества.
Величина давления пара не влияет на их равновесие и поэтому не учитывается. Правило фаз упрощается
С = К – Ф + 1
Диаграмма состояния конденсированных 2-х компонентных систем может быть построена на плоскости t- состав. Она называется диаграммой плавкости.
Это график зависимости t° плавления (отвердения) каждого из компонентов от их концентрации в системе. Диаграмму плавкости строят на кривых охлаждения или нагревания. Они представляют зависимость t° 2-х компонентных систем определенного состава от времени при их равномерном охлаждении или нагревании.
Условия равновесия и состав фаз конденсированных 2-х компонентных систем зависят от характера взаимодействия.
3.1. 2-х компонентные системы без химического взаимодействия.
1) Неизоморфные конденсированные системы.
Системы с неограниченной растворимостью компонентов в жидком и взаимной нерастворимостью в твердом состоянии.
Кривые 1, 2, 3, 4 характеризуют охлаждение сплавов обоих компонентов с избытком одного из них. В начале t° жидкого сплава равномерно снижается. При некоторой t° скорость охлаждения замедляется и наклон кривой становится меньше. Это объясняется тем, что в сплаве появляются кристаллики избыточного компонента и выделяющаяся при этом теплота кристаллизации частично компенсирует теплоту плавления.
По мере выделения кристаллов вещества сплав обедняется им и поэтому t° кристаллизации снижается. Наконец, при определенной t° состав жидкой фазы сплава становится таким, что оба вещества кристаллизуются одновременно. Температура при этом остается постоянной пока сплав не отвердеет полностью. После этого начинается равномерное охлаждение твердого сплава.
Кристаллизация сплавов начинается при разных t° в зависимости от исходного содержания каждого компонента. Окончательное отвердение происходит при одной и той же температуре.
Минимальная t°, при которой начинается плавление 2-хкомпонентной системы (или заканчивается кристаллизация расплава), называется ЭВТЕКТИЧЕСКОЙ температурой Тэ .
Диаграмма температура - состав.
Кривая, отвечающая температурам начала кристаллизации, носит название линии ликвидуса (т.е. жидкости) или просто ликвидуса. Область выше линии ликвидуса характеризует жидкие однофазные системы.

 t° t°
t° t°


 B TB
B TB






 4 4
4 4






 A 3 ликвидус 3
A 3 ликвидус 3


 1 TA 1
1 TA 1


 2 2 В+Ж
2 2 В+Ж
А+Ж солидус







 Е
Е
Е t0э
I II III IV
Время х2 хЕ

 А х1 состав х3 х4 В
А х1 состав х3 х4 В
Рис. 1.3.
По правилу фаз Гиббса следует, что они имеют 2 степени свободы.
К = 2 Ф = 1 С = 2 - 1 + 1 = 2
Это означает, что в определенных пределах можно менять t° и состав жидких 2-х компонентных сплавов и они останутся в жидком виде.
Поля А + ж В +ж представляют области сплавов с избытком одного из компонентов. Они состоят из двух фаз: жидкого сплава обоих компонентов и кристаллов одного из них.
По правилу фаз Гиббса эти фазы с начавшейся кристаллизацией имеют I степень свободы К = 2 Ф = 2 => С = 1
Это означает, что произвольно можно менять I параметр - либо t°, либо состав.
Каждой концентрации сплава отвечает определенная t° начала кристаллизации.
Область ниже линии солидуса - твердые сплавы (А+Эвтектика, В+эвтектика). Они состоят из отдельных кристаллов обоих веществ. Т.к. эти вещества не растворимы друг в друге в твердом виде, по правилу фаз Гиббса твердые неизоморфные 2-х компонентные сплавы имеют I степень свободы
С = 2 - 2 +1 =1
Это означает, что и в твердых сплавах без изменения их фазового состояния можно в определенных пределах менять только t°.
Все поля сходятся в точке Е эвтектики. В т. Е в равновесии находятся три фазы: кристаллы вещества А, кристаллы вещества В и жидкий сплав. В эвтектическом сплаве жидкая и твердая фаза имеют одинаковый состав.
К = 2 Ф = 3 С = 2 - 3 + 1 = 0
Линия, отвечающая температурам конца равновесной кристаллизации (полного отвердения) растворов различного состава, носит название линии солидуса (т.е. твердого тела) или просто солидуса.
Левая кривая показывает равновесие между кристаллами компонента А и растворами различного состава. Она выражает зависимость t° начала кристаллизации компонента А от его концентрации в растворе (и вместе с тем зависимость растворимости компонента А в этих растворах от t°).
Правая кривая подобным образом характеризует равновесие между растворами различного состава и кристаллами компонента В.
Эвтектическая точка соответствует равновесию между жидким раствором (расплавом) и двумя кристаллическими фазами.
Такое равновесие называется эвтектическим равновесием. Соответствующий жидкий раствор, равновесный этим фазам называется эвтектикой.
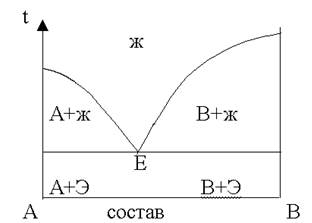 |
Тем же термином (эвтектика) обозначается и твердый продукт (сплав), образующийся при кристаллизации этого раствора и, следовательно, обладающий эвтектическим составом. Жидкий раствор называют жидкой эвтектикой, а твердый сплав - твердой эвтектикой. На диаграмме есть пять полей.
Рис. 1.4. Диаграмма плавкости неизоморфной бинарной системы.
Т.о. ни t, ни состав не могут быть изменены произвольно без того, чтобы не произошло исчезновение одной из фаз такого сплава, либо сплав отвердеет, либо расплавятся кристаллы одного или обоих веществ.
Одновременная кристаллизация обоих компонентов эвтектики мешает образованию крупных кристаллов. Поэтому, эвтектика - это однородная мелкозернистая смесь компонентов одного и другого вещества.
Неэвтектические сплавы в твердом состоянии состоят из первичных кристаллов одного из веществ, сцементированных мелкозернистой структурой эвтектики.
2) Изоморфные конденсированные 2-х компонентные системы.


 3
3

 t 1 3 2 жидкая фаза (расплав)
t 1 3 2 жидкая фаза (расплав)




 ликвидус
ликвидус
t1 t1 расплав +




 кристаллы
кристаллы
 t2 t2 тв.р - ра
t2 t2 тв.р - ра



 солидус
солидус


твердый р - р

 время А100% х2 х0 состав х3 х1 В%
время А100% х2 х0 состав х3 х1 В%
Рис. 1.5. Диаграмма плавкости изоморфной бинарной системы.
Изоморфные смеси образуются веществами со сходным строением кристаллических решеток. Поэтому оба вещества при любом соотношении кристаллизируются совместно и образуют твердый раствор.
При охлаждении смеси состава х0, соответствующей кривой 3 при температуре t1 появляется первый кристалл состава х1. Жидкость, теряя больше компонента В, чем А, обогащается легкоплавким компонентом; поэтому t° ее отвердевания понижается. Составы жидкой и твердой фаз изменяются соответственно по кривым ликвидуса и солидуса. По мере понижения t° (начиная с t1) охлаждения замедляется, процентное содержание твердой фазы растет (это можно определить по правилу рычага).
При t2 затвердевает последняя капля расплава (состав х2) с образованием кристалла состава х3; после этого происходит охлаждение твердого раствора.
Характерной особенностью диаграмм плавкости систем с неограниченной взаимной растворимостью компонентов в жидком и твердом состоянии является отсутствие эвтектики.
Для этих систем известны три типа диаграмм плавкости. В системах первого типа при увеличении концентрации компонента температура начала кристаллизации твердого раствора непрерывно повышается. Линия ликвидуса имеет вид непрерывной кривой, все точки которой лежат между температурами кристаллизации чистых компонентов.
В системах второго типа t° начала кристаллизации твердого компонента понижается при добавлении одного компонента к другому.
Линия ликвидуса имеет вид непрерывной кривой, проходящей через минимум.
В системах третьего типа t° начала кристаллизации твердого раствора повышается при добавлении одного компонента к другому. Линия ликвидуса имеет вид непрерывной кривой, проходящей через максимум.


 t° расплав t° расплав
t° расплав t° расплав
расплав+кристаллы расплав+кристаллы



 твердого в – ва твердого в - ва
твердого в – ва твердого в - ва
 | |||||
 |  | ||||
кристаллы тв.р – ра кристаллы тв.р - ра
 | |||
 |
состав состав
Рис.1.6. Тип 2 Рис.1.7. Тип 3
Согласно первому правилу Гиббса-Розебума, твердый раствор по сравнению с жидким раствором, находящимся с ним в равновесии, богаче тем компонентов, прибавление которого к расплаву повышает t° начала кристаллизации твердого раствора.
По второму правилу Гиббса-Розебума в точках максимума и минимума кривых t° плавления твердый раствор и находящийся с ним в равновесии жидкий расплав имеют одинаковый состав.
3) Конденсированные системы с ограниченной растворимостью в твердом состоянии.
Если система дает твердые растворы с ограниченной растворимостью, то подобно жидким растворам, растворителем считается тот компонент, количество которого в растворе больше.
Для двух веществ возможны два типа растворов, называемых твердыми a и b - растворами.
А в B - b - кристаллы А в В
B в A - a - кристаллы В в А
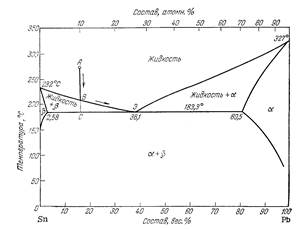 |
Рис. 1.8. Диаграмма плавкости
3.2. Двухкомпонентные системы с химическим взаимодействием веществ.
Вид диаграммы изменяется, если два компонента образуют между собой какое-либо химическое соединение. Диаграмму в координатах t° – состав для одного устойчивого химического соединения можно считать состоящей как бы из двух диаграмм с эвтектикой.


 t c’ B
t c’ B


 c ж
c ж

ж AB+ж В+ж
|

 H g
H g  A
A
А+ж АВ+ж АВ+(АВ+В) В+(АВ+В)

 D E j
D E j
A+(A+AB) AB+(A+AB)
 |
L M N состав AnBm
Рис.1.9. Диаграмма плавкости низоморфной бинарной системы, образующей устойчивое хим.соединение.
Первая диаграмма отвечает системе: вещество А – химическое соединение, вторая - системе химическое соединение - вещество В.
В первой системе образуется эвтектика F (AВ+В). Левее вертикали ЕL и правее вертикали FN происходит кристаллизация с выделением вещества А или соответственно вещества В и последующим выпадением эвтектических смесей Е или F.
Правее вертикали ЕL и левее FN охлаждение расплавов приводит к кристаллизации хим.соединения с последующим выделением эвтектик.
Температура плавления хим.соединения в т. С может быть выше t° плавления чистых компонентов или ниже t° плавления более легкоплавкого компонента. Первый случай наблюдается тогда, когда молекулярное соединение образуется с большим выделением теплоты. По характеру максимума, отвечающего t° плавления хим.соединения АВ, можно судить о его прочности. Частичное разложение соединения в расплаве, происходящее при плавлении, понижает t° плавления. Поэтому для неустойчивых соединений максимум становится менее острым.
Состав хим. соединения точно соответствует положению максимума на диаграмме плавкости.
3.3. Криогидратные смеси.
Диаграммы состояния используются при рассмотрении не только металлических, но и любых других систем. Для примера рассмотрим диаграмму состояния простой системы H2O – AgNO3
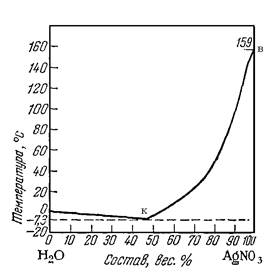
Рис. 1.10.Диаграмма состояния системы H2O – AgNO3
Если при растворении соль не образует с водой кристаллогидратов, то диаграмма их состояния будет такой же как у неизоморфных систем.
т.А - соответствует 0° С - t° замерзания воды.
т.В - отражает t плавления AgNO3. Линия АК показывает, что из растворов содержащих AgNO3 меньше 47% при охлаждении выделяются кристаллы льда. Линия ВК представляет кривую растворимости AgNO3 в H2O.
К - точка эвтектики при -7,3° С.
В односолевых системах она называется криогидратной точкой. В ней система безвариантна.
Ф = С К = 2 С = 0
Поэтому криогидратная точка строго задана как по составу, так и по температуре. Из раствора при этом одновременно выпадают кристаллы льда и AgNO3. Следовательно, при смешивании соли и льда будет происходить смещение температур вследствии образования криогидратной смеси.
Поэтому солевые криогидратные смеси применяются в качестве охлаждающих составов.
 22,5 % NCl + лед криогидратная точка - 21,2°С
22,5 % NCl + лед криогидратная точка - 21,2°С
Если соль образует с водой кристаллогидраты, то диаграмма состояния оказывается такой же, как у двухкомпонентных систем с химическим взаимодействием.
Каждому кристаллогидрату соответствует максимум на кривых плавления. Есть несколько криогидратных точек.
Диаграммы состояния водно-солевых систем используют при изучении характера растворения солей, установления их растворимости и установление их смеси. Нередко способность веществ образовывать криогидратные смеси приходится учитывать при составлении механических композиций.
 2015-06-04
2015-06-04 6641
6641