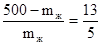 , отсюда mж = 139 г
, отсюда mж = 139 г
Т.к. при эвтектической температуре устойчивым может быть только жидкий раствор эвтектического состава, целиком превращающийся в эвтектику, то искомое количество эвтектики тоже будет равно 139 г.
2.4. Задача. Воспользовавшись диаграммой плавкости системы Fe - V (рис.ниже), определить:
1. Какая часть 55%-ного расплава затвердеет, если охладить его до 1500°С?
2. Сколько ванадия перейдет в твердую фазу, если 1 кг 75%-ного расплава охладить до 1600°С?
3.
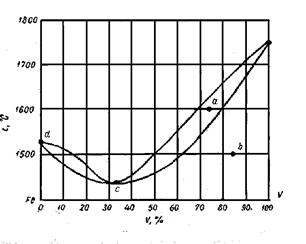 |
Сколько перейдет железа в жидкую фазу, если 500 г 15%-ного сплава нагреть до 1475°С?
Рис.4
РЕШЕНИЕ:
1. Обозначив количество твердого раствора через mтв, а количество жидкого через mж, по правилу рычага имеем
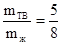
Приняв вес всей системы за 1, имеем
mтв +mж = 1
Из двух уравнений находим, исключив mж, 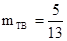
2. Определяем по правилу рычага количество твердой фазы
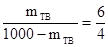 , отсюда mтв = 600
, отсюда mтв = 600
Как видно из диаграммы, твердый раствор, находящийся в равновесии с жидким при 1600°С, содержит 79% V, а т.к. количество твердого раствора равно 600 г, то количество ванадия в нем равно
0,79 × 600 = 474 г.
3. Если нагреть 15%-ный сплав до 1475°С, то, как видно из диаграммы, половина его перейдет в жидкое состояние, т.е. в нашем случае образуется 250 г жидкого сплава. В этом сплаве содержится (см. диаграмму) 80% Fe, так что количество железа перешедшего в жидкую фазу, будет равно
0,8 × 250 = 200 г
2.5. Задача. По диаграмме плавкости системы Fe – V (см.рис.4)
1. определить число степеней свободы системы в точках а, в, с и d;
2. указать, в каких пределах изменяется состав жидкого и твердого растворов при затвердевании 60%-ного расплава;
3. ответить на вопрос: определяется ли заданием состава твердого раствора состав жидкого и температура, при которой эти растворы находятся в равновесии. Находится ли ответ в согласии с правилом фаз?
РЕШЕНИЕ:
1.Система, состояние которой изображается точкой а, состоит из двух фаз и двух компонентов, следовательно, число степеней свободы С=2+1-2=1.
Точкой в изображается состояние однофазной системы, и число степеней свободы С=2.
Точка с отвечает двухфазной системе, но число степеней свободы равно 0, т.к. обе фазы имеют одинаковый состав, т.е. система ведет себя как однокомпонентная.
В точке d один компонент и две фазы, поэтому С=1+1-2=0.
2. При кристаллизации любого сплава состав жидкой фазы изменяется по линии ликвидус, а состав твердой - по линии солидус. Кристаллизация 60%-ного сплава начинается при 1550 и заканчивается при 1485°С. При этом состав жидкого раствора изменяется от 60 до 48 % V, состав твердого - от 72 до 60 % V.
3. Пусть твердый раствор содержит 79% V. Из диаграммы видно, что этот твердый раствор может находиться в равновесии только с 69%-ным жидким раствором и только при 1600°С.
Таким образом, заданием состава твердого раствора определяется и состав жидкого, и температура. Ответ находится в согласии с правилом фаз, т.к. при К=2 и ф=2 число степеней свободы С=1, а это и значит, что состояние системы определяется заданием одной переменной.
2.6.
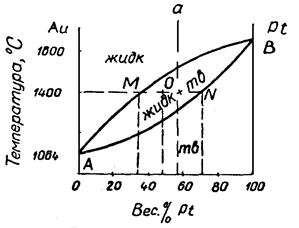 |
Задача. Золото и платина смешиваются в жидком состоянии во всех соотношениях, в твердом состоянии образуют непрерывный ряд твердых растворов. Применяя диаграмму состояния этих сплавов (см.рис.5): а)построить кривую охлаждения сплава, состоящего из 60 % платины и 40% золота; б) определить состав и количественное соотношение твердой и жидкой фаз при 1400°С для сплава, содержащего равные количества обоих компонентов.
Рис. 5. Диаграмма состояния Au - Pt
РЕШЕНИЕ:
А) Для построения кривой охлаждения проследим, через какие области диаграммы пройдет фигуративная точка а. Выше линии АМВ точка движется в гомогенной области жидкого расплава. При достижении линии АМВ из жидкого расплава начинают выпадать кристаллы твердого раствора. В связи с этим составы жидкой и твердой фаз изменяются. Состав твердой фазы по мере понижения температуры изменяется по линии солидуса (линия АNВ), а состав жидкой фазы - по линии ликвидуса (линия АМВ). На кривой охлаждения мы будем наблюдать два перегиба: в точке пересечения с линией ликвидуса и в точке пересечения с линией солидуса.
Б)Для определения количественного соотношения твердой и жидкой фаз применимо правило рычага. Для этого от точки О (точка пересечения перпендикуляра, восстановленного из точки на оси концентраций, соответствующей сплаву из 50% платины и 50% золота, и прямой, проходящей через 1400°С) измеряем длину отрезков ОN и ОМ; соотношении их длин соответствует количественному соотношению интересующих нас фаз.
Допустим для нашего случая длина отрезка ОN равна 15 мм, а дли отрезка ОМ - 10 мм. Тогда соотношение жидкой и твердой фаз составит 10: 15. Зная количество сплава, можно рассчитать и количество каждой фазы. Предположим, что вес сплава 5 кг. Это количество будет пропорционально всей длине линии МN, т.е. 10 + 15 =25мм. Тогда количество твердой фазы будет равно 15: 25 = Х: 5, откуда Х = 3 кг. Состав легко же определяется, если из конечных точек прямой МN опустить перпендикуляры на ось концентраций. Перпендикуляр, опущенный из точки М на ось концентраций определяет состав жидкой фазы, а перпендикуляр, опущенный из N дает состав твердой фазы. В нашем случае состав твердой фазы содержит около 65% платины, а состав жидкой фазы - 30 % платины.
3. Перегонка. Состав смеси.
3.1. При 95,25°С давление паров воды равно 639 мм.рт.ст., а бромбензола - 121 мм.рт.ст. Обе жидкости не растворимы друг в друге. Определить, в каком весовом соотношении будут перегоняться бромбензол и вода.
РЕШЕНИЕ:
Молекулярный вес бромбензола равен 157 г/моль, а воды – 18 г/моль. Для решения применим уравнение
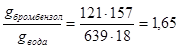
Таким образом, отношение веса бромбензола к весу воды в дистиляте будут составлять 1,65, т.е. на 100 кг перегнанной воды будет приходиться 165 кг бромбензола. Соотношение числа молей этих веществ составит 121: 639 = 1: 5, т.е. с 1 молем бромбензола будет перегоняться 5 молей воды.
3.2. Задача. Две жидкости А и В неограниченно растворимы друг в друге. Давление пара этой смеси при 150°С представляет линейную функцию от концентрации. Давление пара компонента А при этой температуре равно 800 мм, а компонента В - 500 мм. Определить состав смеси, кипящей при этой температуре под давлением 760 мм.рт.ст.; Вычислить отношение числа молей компонента А к числу молей компонента В в парах над смесью содержащей 5 мол.% компонента А.
РЕШЕНИЕ:
а) по уравнению Р=Ха(Ра-Рв)+Рв определяем мольную долю вещества А в смеси, кипящей под давлением 760 мм.рт.ст.,
760 = Ха (800-500) + 500,
откуда
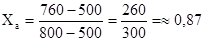
1 - Ха = 1 - 0,87 = 0,13
Следовательно, смесь, кипящая при давлении 760мм.рт.ст. и температуре 150°С содержит 0,87 мольных долей компонента А и 0,13 мольных долей компонента В или 87 мол.% компонента А и 13 мол.% компонента В.
б) Для определения соотношения компонентов А и В в парообразной фазе рассчитываем величины парциальных давлений этих компонентов над смесью, состоящей из 5 мол.% вещества А и 95 мол.% вещества В. Для этого воспользуемся уравнением
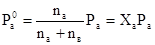
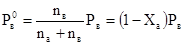
При подстановке в них числовых значений (Ха = 0,05, Ра=800 мм.рт.ст и Рв= 500мм.рт.ст.) получаем
Ра = 0,005 х 800 = 40 мм.рт.ст.
Рв = 0,95 х 500 = 495 мм.рт.ст.
Соотношение числа молей в парообразной фазе равно соотношению парциальных давлений компонентов. Отсюда, по уравнению находим
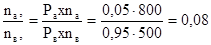
Т.е. на 8 молей вещества А приходится 100 молей вещества В над жидкой смесью, состоящей из 5 мол.% вещества А и 95 мол.% вещества В при температуре 150°С. При этом общее давление пара над смесью будет равно сумме парциальных давлений компонентов т.е. 40 + 495 =535 мм.рт.ст.
4. Закон распределения. Экстракция.
4.1. Коэффициент распределения пикриновой кислоты между бензолом и водой равен 35. Чему равна концентрация пикриновой кислоты в бензольном слое, если концентрация ее в водном растворе равна 0,04 г моль/л? Кислота диссоциирует в воде и имеет константу диссоциации, равную при данных условиях 0,164.
РЕШЕНИЕ:
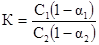 ;
; 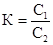
a1 - степень диссоциации в первом растворителе
a2 - степень диссоциации во втором растворителе
Для определения концентрации кислоты в бензольном слое воспользуемся уравнением выше. Т.к. пикриновая кислота в бензольном растворе не претерпевает изменений, то степень диссоциации ее в этом случае равна 0 (a1). Для вычисления степени диссоциации кислоты в водном растворе заданной концентрации напишем закон действующих масс для бинарного электролита, которым является пикриновая кислота.
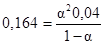
Откуда 0,04a2 + 0,164a - 0,164 = 0 и a =0,83. После подстановки числовых данных в уравнение получаем 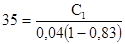
Отсюда
С1 = 35 × 0,04 (1-0,83) = 0,238 моль
4.2. Задача. Коэффициент распределения этилового спирта между четыреххлористым углеродом и водой равен 0,0244. Каковы будут концентрации (моль/л) спирта в равновесных растворах, если 0,1 моль спирта распределяется между 300 мл воды и 500 мл CCl4?
РЕШЕНИЕ:
В условиях нет указаний на различие в молекулярных весах растворенного вещества в равновесных растворах: поэтому для решения воспользуемся уравнением
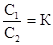
Где С1 - концентрация растворенного вещества в одном растворителе,
С2 – концентрация растворенного вещества в другом растворителе,
К - коэффициент распределения
Причем первым будем считать тот растворитель, который первым упомянут в условии (CCl4). Обозначим через Х число молей спирта, перешедшего в четыреххлористый углерод, тогда
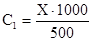
В воду перейдет оставшееся количество спирта, равное (0,1-Х) моль, следовательно,
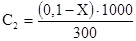
Подставив С1 и С2 в уравнение получим
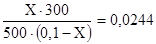
Откуда Х=0,0039 моль
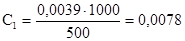 моль/л
моль/л
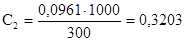 моль/л
моль/л
4.3. Задача. При очистке сточных вод, содержащих до 1,5 кг/м3 фенола, непрерывной экстракцией диизопропиловым эфиром, содержание фенола в них снижается до 0,2 г/ м3. Определите коэффициент распределения фенола между водой и диизопропиловым эфиром, если эффективное число ступеней экстракции равно 5, а расход экстрагента на каждую ступень экстракции составляет 1/5 объема очищаемой воды.
РЕШЕНИЕ:
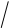 Преобразуем формулу, решив ее относительно коэффициента распределения:
Преобразуем формулу, решив ее относительно коэффициента распределения:

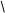
 K = Vэ / [V0 (n g0 / gn - 1)]
K = Vэ / [V0 (n g0 / gn - 1)]
Если принять Vэ = 1,0 м3, то согласно условиям задачи, по которым
 n = Vэ/V0 = 5, имеем: V0 = 5,0 м3. Отсюда получаем
n = Vэ/V0 = 5, имеем: V0 = 5,0 м3. Отсюда получаем

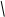
 К = 1,0 / [5,0 (5 1,5/0,2 - 1)] = 0,403
К = 1,0 / [5,0 (5 1,5/0,2 - 1)] = 0,403
4.4. Задача. В 1 л воды растворено 0,3 г кристаллического йода. Сколько раз необходимо экстрагировать этот раствор сероуглеродом порциями по 100 мл, чтобы довести концентрацию йода в воде до 1х10-6 г/л? Коэффициент распределения йода между водой и сероуглеродом составляет 0,0017.
 РЕШЕНИЕ:
РЕШЕНИЕ:
 Основная формула: gn = g0 KV0 n
Основная формула: gn = g0 KV0 n
Vэ + KV0
Где g0 - начальное количество вещества, подвергающееся
экстрагированию,
V0 - объем раствора, в котором находится экстрагированное
вещество,
Vэ - объем экстрагирующего растворителя, израсходованный
на одно экстрагирование,
n - общее число экстрагирований,
у1 , у2 …. уn - количества вещества, остающиеся после первого,
второго и т.д. экстрагирований,
К - коэффициент распределения.
 |
 Lg gn = Lg g0 + n Lg KV0 , откуда
Lg gn = Lg g0 + n Lg KV0 , откуда
Vэ + KV0
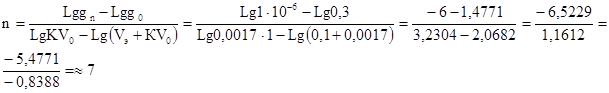
ЗАДАЧИ
Правило фаз Гиббса и фазовые диаграммы.
1. Определить число степеней свободы в системе, состоящей из:
а) льда, б) воды, в) пара.
2. Определить число степеней свободы в системе


 Лед вода пар
Лед вода пар
3. Определить число степеней свободы в системе
 CaCO3 CaO + CO2
CaCO3 CaO + CO2
4. В производстве серной кислоты известна реакция получения нитрозилсерной кислоты (NOHSO4) по схеме
N2O3(газ) + 2H2SO4(75% р-р-) = 2 NOHSO4 + H2O(жидк)
Применить к системе правило фаз
5. 
 Карбид кальция получают по уравнению CaO(тв) + 3С CaC2(тв)+ CO
Карбид кальция получают по уравнению CaO(тв) + 3С CaC2(тв)+ CO
Определить фазовый состав и число степеней свободы системы.
6. Определить фазовый состав и степень свободы системы
CaC2(тв)+2 H2O(ж) = С2H2(газ) +Ca(OH)2(ТВ)
7. Цианамид кальция разлагается водой по уравнению
CaCN2(тв)+3H2O = CaCO3(тв) + 2NH3(газ)
Определить фазовый состав и степень свободы системы.
8. Цианамид кальция получают нагреванием в печи карбида кальция в
атмосфере азота по реакции CaC2(тв)+N2 = CaCN2(тв) + C.
Определить фазовый состав и степень свободы системы.
9. Карбид кремния получают нагреванием до 2000°С смеси песка и угля
SiO2(тв) + 3С(тв) = SiC(тв) + 2СO(газ) + 122 ккал/моль.
Определить фазовый состав и степень свободы системы.
10. Фосфор получают по реакции
2Ca3(PO4 )2(тв) + 10C(тв) = 6CaO(тв) + P4(тв) +10CO(газ)
которая протекает при 1 атм и 1385°С с поглощением большого коли-
чества тепла (DH = 837,7 кал). Определить фазовый состав и степень
свободы системы.
11. Определить вариантность системы, состоящей из раствора К2SO4 и
Na2SO4 в воде, в присутствии паров воды и кристаллов обеих солей.
12. Определить вариантность системы, состоящей из раствора К2SO4 и
NaCl в воде, в присутствии кристаллов обеих солей.
13. Какое максимальное число фаз может иметь система, состоящая из раствора хлористого кальция, хлористого стронция и хлористого бария в воде?
14. Какое максимальное число фаз может иметь сплав, состоящий из свинца, олова и висмута?
15. Из жидкого расплава свинца и сурьмы частично выпали кристаллы сурьмы. Сколько степеней свободы имеет такая система?
16. При 144°С жидкий расплав, состоящий из 40 % кадмия и 60 % висмута находится в равновесии с твердыми кристаллами кадмия и висмута. Определить вариантность этой системы?
17. Методы очистки газов от сернистых соединений основаны на реакциях:
3H2S(г) + 2Fe(OH)3(тв) = Fe2S3(тв) + 6H2O(г)
2Fe2S3(тв) + 3О2(г) + 6H2O(г) = 4Fe(OH)3(тв) + 6S(тв)
 2015-06-04
2015-06-04 2853
2853








