В концентрационных цепях оба электрода идентичны как по физическому состоянию, так и по химической природе участников окислительно – восстановительных процессов; они отличаются только концентрацией компонентов Ox или Red. Источником электрической энергии является разность свободных энергий Гиббса, обусловленная различными активностями одних и тех же химических компонентов. Концентрационные цепи можно приготовить из амальгам разных концентраций в одном и том же растворе; из одинаковых электродов первого, второго или третьего рода, находящихся в растворах разной концентрации; из одинаковых газовых электродов, работающих при разных давлениях газов.
Концентрационные цепи без переноса (без границы двух растворов).
Результатом работы концентрационной цепи всегда является выравниванием концентраций растворов (энтропийный фактор). ЭДС таких цепей очень мала (обычно ~ 1 – 100 мВ).
Амальгамная цепь. Pt|Zn(Hg)|ZnSO4|Zn(Hg)|Pt,
а1 а2
где а1 и а2 – активности цинка в амальгамах.
Амальгама – раствор (твердый или жидкий), сплав металла и ртути. ЭДС амальгамной цепи аналогична мембранной разности потенциалов.
E=-E1 + E2 = - 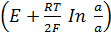 +
+ 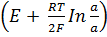 =
= 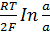
Если активности различаются в 10 раз, то Е = 33, 4 мВ.
В общем случае Е = 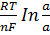
Концентрационные цепи с переносом (с границей двух растворов).
M|MV+ AV- MV+ AV-|M
а3(1) а3(2)
Для расчета ЭДС концентрационной цепи с переносом к общей формуле
E=-E1 + E2 = 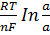 нужно прибавить диффузионный потенциал на границе растворов Δ
нужно прибавить диффузионный потенциал на границе растворов Δ 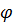 дифф = Δ
дифф = Δ 
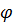 , который нельзя точно рассчитать или измерить. Если полагать, что числа переноса не зависят от концентрации, то
, который нельзя точно рассчитать или измерить. Если полагать, что числа переноса не зависят от концентрации, то
Δ 
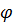 = -
= - 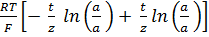
Учитывая, что t + = 1 – t – и z+ = n/v + и I z – I = n/v - ; где n=z+ v+ = Iz- I v- , можно упростить полученную сумму
Е = t 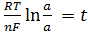
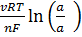
где a3 = a+v + a-v – активность соли, a± = 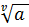 - средняя активность.
- средняя активность.
ПРИМЕР концентрационной цепи с переносом
Cu|CuCl2 CuCl2 |Cu
a±(1) a±(2)
для которой v=3, n=2, а потому
Е = t 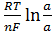 = t
= t 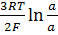 .
.
Если в растворе соли 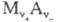 может работать не только электрод первого рода, обратимый по катионам, но и электрод второго рода, обратимый по анионам, можно построить концентрационную цепь без переноса, содержащую два раствора соли
может работать не только электрод первого рода, обратимый по катионам, но и электрод второго рода, обратимый по анионам, можно построить концентрационную цепь без переноса, содержащую два раствора соли 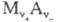 различной концентрации:
различной концентрации:
Например для цепи Cu |CuCl2| AgCl, Ag | Cu| Ag, AgCl | CuCl2 | Cu
a±(1) a±(2)
Е = 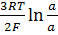 .
.
В общем случае такую цепь записывают в виде
M | Mv+ Av- | N | M | N | Mv+ Av- | M
а3(1) а3(2)
здесь N – электрод второго рода, обратимый по анионам A z-, т.е. труднорастворимая соль с анионом Az- и соответствующий металл.
ЭДС такой цепи рассчитывают по уравнению Нернста для электродов 2 рода:
E=E1 - E2 = 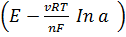 -
- 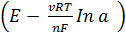 =
= 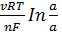 .
.
 2015-06-13
2015-06-13 2360
2360
