Количественными характеристиками процесса диссоциации являются степень и константа электролитической диссоциации.
Степень электролитической диссоциации ( α ) показывает отношение числа продиссоциированных молекул к их общему числу. Выражается в относительных единицах и в процентах:
α = 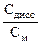 , отн. ед. или α =
, отн. ед. или α = 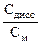 ×100, %,
×100, %,
отсюда: Сдисс = α ∙См, и Сион = См ∙α∙ n,
где Сдисс- концентрация продиссоциировавших молекул, См – молярная концентрация раствора, Сион – концентрация ионов, n – количество ионов данного вида, образующееся при диссоциации одной молекулы.
Экспериментально было установлено, что законы Вант-Гоффа и Рауля, выведенные для определения физических свойств растворов (относительное повышение давления насыщенного пара, повышение температуры кипения и замерзания растворов и осмотическое давление (ΔР/Р0, Δtкип. и Δtзам., Росм) неприменимы к растворам электролитов. Это объясняется тем, что в результате электролитической диссоциации суммарное число частиц (молекул и ионов) в растворе электролитов возрастает и становится больше числа растворенных молекул. В соответствии с этим число частиц в растворах электролитов больше числа частиц в растворах неэлектролитов той же концентрации.
Для того, чтобы математическое выражение законов Вант-Гоффа и Рауля были справедливыми и для разбавленных растворов электролитов, вводится поправочный коэффициент i – изотонический коэффициент или коэффициент Вант-Гоффа.
Для растворов электролитов формулы имеют следующий вид:
ΔР = 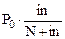 ; Δtкип. = i Kэб.Сm и Δtзам = i Kкр.Сm; Росм. = i СмRТ.
; Δtкип. = i Kэб.Сm и Δtзам = i Kкр.Сm; Росм. = i СмRТ.
Изотонический коэффициент i связан со степенью диссоциации (α) и количества ионов, образующихся при диссоциации одной молекулы электролита (k):
i = 1 + α (k –1) или α = (i –1)/(k – 1)
Например, для сульфата алюминия: Al2(SO4)3 = 2 Al3+ + 3 SO42- k = 2 + 3 =5, и при α = 1 i= 5
Пример 1. Рассчитать концентрацию ионов [Na+] в 1литре раствора, содержащего 0,02 моля Na2SO4 + 0,01 моля Na3PO4, если степень диссоциации солей принять за 1 (100%)
[Na+] = 0,02 · 2 + 0,01 · 3 = 0,07моль/л.
Пример 2. Определить концентрацию [H+] и [SO42–] в 0,2 н растворе серной кислоты (α принять равной 1) в моль/л и г/л.
Решение. [H+]= См α n; 0,2 н (H2SO4) = 0,1 М; H2SO4 = 2Н+ + SO42–; nН+ =2; nSO42–=1; [H+] =0,1·1·2 = 0,2 моль/л или 0,2·1 = 0,2 г/л;
[SO42–] = 0,1·1·1= 0,1 моль/л, или 0,1·96 = 9,6 г/л, где МSO42- = 96.
Пример 3. Вычислить концентрацию нитрат-ионов в 0,04 нрастворе нитрата магния (в моль/л и г/л), если кажущаяся степень диссоциации соли составляет 65%.
Решение. [NO3–] = См ∙α∙ n, нитрат магния диссоциирует с образованием одного иона магния и двух нитрат-ионов: Mg(NO3)2 = Mg2+ +2NO3–; то есть nNO3– = 2; поскольку CMg(NO3)2 = 0,04 н = 0,02 М; концентрация нитрат-ионов равна: [NO3–] = 0,02·0,65·2 = 0,026 моль/л или 0,026·62 = 1,612г/л, где МNO3–= 62.
Пример 3. Вычислить давление насыщенного пара раствора. содержащего 5,61г КОН в 990г воды при 400С. Степень диссоциации КОН α = 0,87.Давление насыщенного пара воды при 400 С составляет 7,37 кПа.
Решение: Для вычисления давления насыщенного пара раствора электролита (Р) используем формулу 1-го закона Рауля с поправочным изотоническим коэффициентом i:
Р0 –Р = 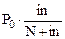 ; выразив Р, получим:
; выразив Р, получим:
Р = Р0 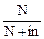 ; а изотонический коэффициент зависит от степени диссоциации
; а изотонический коэффициент зависит от степени диссоциации
(α = 0,87) и количества ионов (k), на которое диссоциирует одна молекула электролита (в нашем случае КОН ⇄ К+ + ОН–, k = 2), следующим образом: i = 1 + α (k – 1), тогда i = 1 + 0,87(2 – 1) =1,87;
n = 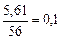 ; N =
; N = 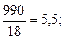 Р = 7,37·
Р = 7,37· 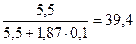 кПа.
кПа.
Пример 4. Температура кипения 3,2%-ного раствора BaCl2 составляет 100,2080С. Вычислить степень диссоциации соли в растворе.
Решение: Воспользуемся 2-м законом Рауля: - ∆tкип = i Kэб·Cm = 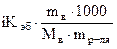 . Раствор содержит 3,2 г соли на 96,8 г воды.
. Раствор содержит 3,2 г соли на 96,8 г воды.
Δtкип = 100,208 – 100 = 0,20800 С; i = 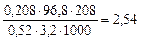 , из формулы i = 1 + α (k –1) выразим α: α =
, из формулы i = 1 + α (k –1) выразим α: α = 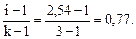
Найдем i: 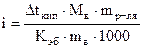 .
.
Пример 5. Вычислите осмотическое давление (при 170 С) раствора Na2SO4, в 1 л которого содержится 7,1 г растворенной соли. Степень диссоциации соли в растворе составляет 0,69.
Решение: Воспользуемся законом Вант-Гоффа:
Росм. = i СMRТ; Na2SO4D2Na+ + SO42–; k=3;
i = 1 + α (k – 1) = 1 + 0,69 (3 - 1) = 2,38, R = 8,31 Дж/(моль·К);
СM 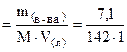 = 0,05 моль/л;
= 0,05 моль/л;
Росм = 2,38·0,05·8,31·290 = 286,8 кПа.
Константа диссоциации – это константа равновесия системы, возникающей в растворе слабого электролита, например:
HCN ⇄ H+ + CN-
Применив закон действующих масс, получим
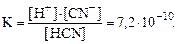
K зависит от природы реагирующих веществ и от температуры.
Взаимосвязь между степенью и константой диссоциации описывается
законом разбавления Оствальда: при разбавлении растворов слабых электролитов степень электролитической диссоциации возрастает:
α ≈ 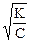
Пример 6. Константа диссоциации муравьиной кислоты НСООН, диссоциирующей по уравнению НСООН ↔ Н+ + СОО–, составляет 2,1·10–4. Вычислите α и [H+] для 0,3 М раствора этой кислоты.
Решение: Для нахождения α воспользуемся законом разбавления Оствальда для слабых бинарных электролитов: 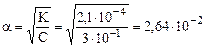 , что соответствует 2,64%. Зная α, определим концентрацию ионов H+:
, что соответствует 2,64%. Зная α, определим концентрацию ионов H+:
[H+] = C α = 0,3·2,64·10–2 = 7,9·10–3 моль/л.
Степень диссоциации слабого электролита резко снижается при добавлении к нему сильного электролита с одноименным ионом.
Пример 7. Константа диссоциации хлорноватистой кислоты HClO равна
3·10–8. Определить степень диссоциации кислоты и [H+] в 0,1 М растворе. Как изменится [H+], если к 1 л 0,1 М раствора HClO добавить 60 г гипохлорита натрия NaClO, диссоциирующего при этом на 75%?
Решение: HClO ↔ H+ + ClO–
Обозначим [H+] = [ClO–]= x; [HClO] ≈ 0,1 моль/л;
а) воспользуемся законом разбавления Оствальда для нахождения [H+]:
[H+] = 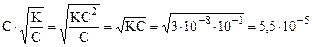 моль/л;
моль/л;
α = 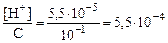 ;
;
б) Добавление 60 г NaClO с α = 0,75 изменит [ClO–].
См(NaClO) = 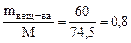 моль/л; [ClO–]=0,8·0,75=0,6 моль/л
моль/л; [ClO–]=0,8·0,75=0,6 моль/л
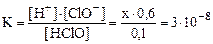 ; x = [H+] = 5·10–9 моль/л.
; x = [H+] = 5·10–9 моль/л.
В присутствии одноименного иона ClO- концентрация [H+] и α уменьшились в 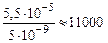 раз.
раз.
 2015-06-14
2015-06-14 2561
2561