Сильные электролиты диссоциированы в растворе нацело (α = 1). Это подтверждают спектральные исследования растворов сильных электролитов: в этих растворах не обнаружено недиссоциированных молекул, то есть процесс диссоциации необратим и константа равновесия не имеет смысла. В связи с этим диссоциация сильных электролитов не подчиняется закону действующих масс. Установлено также, что величина электропроводности раствора сильного электролита не соответствует полной диссоциации вещества на ионы. Это объясняется тем, что электропроводность растворов зависит не только от степени диссоциации электролита, но и от их подвижности.
При растворении и диссоциации кристаллических веществ, например, NаСl или КСl в раствор переходят гидратированные ионы, а не молекулы электролита. Полярные молекулы воды образуют вокруг ионов Nа+, К+ и Сl– гидратные оболочки – «шубы», между которыми возникают электростатические силы притяжения, что и приводит к снижению подвижности ионов. Поэтому определенная по электропроводности степень диссоциации (α) оказывается «кажущейся».
Межионные силы влияют на другие физические свойства растворов: давление насыщенного пара, температуры кипения и замерзания растворов, осмотическое давление, способность ионов к химическим реакциям. Поэтому для растворов сильных электролитов определяют так называемые активные концентрации или активности ионов.
Под активностью иона понимают ту эффективную («кажущуюся») концентрацию его, которая соответствует определенным свойствам раствора. Активность иона (а) пропорциональна его концентрации:
а иона = f Cиона,
где f – коэффициент активности.
В водных растворах коэффициент активности зависит от концентрации и валентности всех присутствующих ионов. Для характеристики этой зависимости введено понятие ионная сила раствора (μ). Ионная сила раствора равна полусумме произведения концентраций всех присутствующих в растворе ионов на квадраты их зарядов:
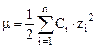
Чем больше ионная сила раствора, тем меньше коэффициент активности каждого иона и меньше его активная концентрация
Коэффициент активности находят по табличным данным или по формуле Дебая-Гюккеля: lg f = 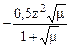 .
.
Для разбавленных растворов (0,01 – 0,05 н) – по упрощенной формуле: lg f = – 0,5 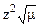 .
.
Пример 8. Вычислить ионную силу раствора, в 1л которого содержится 0,5 моля CaCl2 и 0,1 моля HCl.
Решение: μ = ½{[Ca2+]·z2(Ca2+) + 2[Cl–]·z2(Cl–) + [H+]·z2(H+) + [Cl–]·z2(Cl–)}=
= ½ {0,5· 22 + 2· 0,5 · 12 + 0,1· 12 + 0,1· 12} = 1,6.
Пример 9. Вычислить ионную силу раствора, содержащего 0,5 М CaCl2 и 0,1М HCl.
Решение: μ = ½{[Ca2+]·z2(Ca2+) + 2[Cl–]·z2(Cl–) + [H+]·z2(H+) + [Cl–]·z2(Cl–)}=
= ½ {0,5· 22 +2· 0,5 12 + 0,1· 12 + 0,1· 12} = 1,6.
 2015-06-14
2015-06-14 1793
1793
