В условиях солевого стресса токсическое действие ионов наблюдается при их накоплении в цитоплазме. У растений, различающихся по устойчивости к солям, эффективность механизмов, поддерживающих ионный гомеостаз, различна. В норме концентрации Na+ и С1  в цитоплазме клеток гликофитов и галофитов поддерживаются приблизительно на одинаковом уровне. Этот уровень, как правило, не превышает нескольких ммоль/кг сырой биомассы. У гало-
в цитоплазме клеток гликофитов и галофитов поддерживаются приблизительно на одинаковом уровне. Этот уровень, как правило, не превышает нескольких ммоль/кг сырой биомассы. У гало-
фитов способность поддерживать такие низкие концентрации Na+ и С1  в цитоплазме выработалась при росте на засоленных почвах. В отличие от галофитов гликофиты не в состоянии справиться с задачей поддержания низких концентраций ионов в цитоплазме в условиях засоления. Способность солеустойчивых растений поддерживать при засолении цитоплазматические концентрации ионов на низком уровне подтверждается, в частности, высокой чувствительностью к Na+ и С1
в цитоплазме выработалась при росте на засоленных почвах. В отличие от галофитов гликофиты не в состоянии справиться с задачей поддержания низких концентраций ионов в цитоплазме в условиях засоления. Способность солеустойчивых растений поддерживать при засолении цитоплазматические концентрации ионов на низком уровне подтверждается, в частности, высокой чувствительностью к Na+ и С1  биополимеров цитоплазмы их клеток. Показано, например, что in vitro гомологичные ферменты, выделенные из пресноводных и галотолерантных (солеустойчивых) водорослей, а также их органеллы проявляют практически одинаково высокую чувствительность к NaCl (рис. 8.14).
биополимеров цитоплазмы их клеток. Показано, например, что in vitro гомологичные ферменты, выделенные из пресноводных и галотолерантных (солеустойчивых) водорослей, а также их органеллы проявляют практически одинаково высокую чувствительность к NaCl (рис. 8.14).
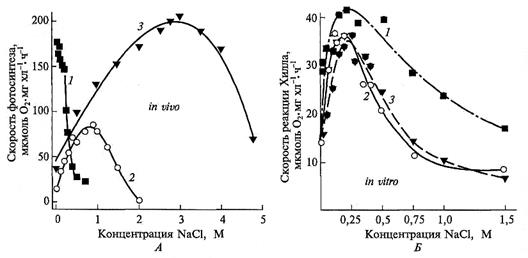
Рис. 8.14. Зависимости скорости выделения О2 от концентрации NaCl у интактных клеток водорослей при фотосинтезе (А) и у выделенных из этих же водорослей хлоропластов в реакции Хилла (Б) (Ю.В.Балнокин, 1995).
Три вида водорослей различаются по солеустойчивости: 1 — пресноводная водоросль Chlorella pyrenoidosa; 2 — морская водоросль Dunaliella maritima; 3 — водоросль Dunaliella salina, обитающая в водоемах с предельно высокими концентрациями NaCl. При измерении скорости выделения О2 клетки и выделенные из них хлоропласты были освещены светом насыщающей интенсивности. Несмотря на резкие различия в солеустойчивости этих организмов, о чем свидетельствуют различия в оптимальных концентрациях NaCl для фотосинтеза интактных клеток, выделенные из них хлоропласты характеризуются одинаковой чувствительностью к соли
Стратегия избежания токсического действия солей, основанная на ионном гомеостатировании цитоплазмы, сформировалась на ранних этапах эволюционного развития органического мира. Из организмов, обитающих в наше время на засоленных субстратах, только у галофильных (солелюбивых) бактерий адаптация к токсическому действию солей строится не на основе регуляции цитоплазматических концентраций ионов, а на основе специфической структуры их белков, позволяющей белкам функционировать в микроокружении с высокой концентрацией Na+. Примером таких бактерий является Halobacterium halobium. Водорастворимые белки цитозоля, а также мембраносвязанные и рибосомальные белки клеток галофильных бактерий характеризуются повышенным содержанием дикарбоновых аминокислот (глутаминовой и аспарагиновой), вследствие чего изоэлектрические точки этих белков смещены в кислую область (рис. 8.15).
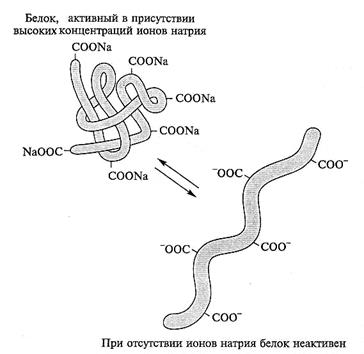
Рис. 8.15. Кислые белки галофильных бактерий.
Водорастворимые, мембраносвязанные и рибосомальные белки галобактерий характеризуются высоким содержанием дикарбоновых аминокислот. Для поддержания структуры таких белков необходимы высокие концентрации ионов Na+ или К+, нейтрализующих ионизованные карбоксильные группы
В нейтральной среде цитоплазмы кислые белки несут отрицательные заряды, которые должны быть нейтрализованы катионами. Наличие ионов в высоких концентрациях в цитоплазме не только допустимо, но даже необходимо для таких белков. В противном случае за счет электростатического отталкивания неизбежна денатурация. В клетках галофильных бактерий суммарная концентрация Na+ и К+ измеряется молями. По-видимому, столь высокие концентрации ионов в клетках галобактерий нужны также для стабилизации гидрофобных взаимодействий в белках. Клетки всех прочих современных организмов, включая остальные прокариоты, клетки животных, растений и грибов, поддерживают низкие концентрации Na+ (и С1  ) в цитоплазме.
) в цитоплазме.
Поддержание цитоплазматических концентраций того или иного иона на определенном уровне основывается на балансе входящих и выходящих потоков этого иона. В частности, цитоплазматические концентрации Na+ определяются балансом скоростей пассивного поступления Na+ в цитоплазму и его активного выведения (экспорта) из цитоплазмы.
Для простоты рассмотрим сначала клетку без крупной центральной вакуоли (рис. 8.16, А).
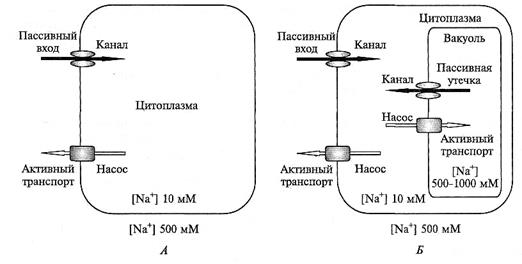
Рис. 8.16. Потоки Na+ через плазмалемму и тонопласт у морских водорослей:
А — клетка морской микроводоросли, лишенная крупной центральной вакуоли. Ионы Na+ поступают пассивно из наружной среды в цитоплазму через ионные каналы плазмалеммы. Низкие концентрации Na+ в цитоплазме поддерживаются благодаря работе локализованного в ПМ Na+-насоса. Транспорт Na+ наружу происходит с затратой метаболической энергии; Б — клетка морской водоросли с крупной центральной вакуолью. Ионы Na+ поступают пассивно в цитоплазму не только из наружной среды, но и из вакуоли. Активный транспорт Na+ осуществляется как в наружную среду, так и в вакуоль. Градиенты электрохимического потенциала Na+ формируются
на ПМ и тонопласте
Такое строение типично для меристематических клеток высших растений, а также для многих морских и пресноводных одноклеточных водорослей. Наличием компартмента, образованного микровакуолями, можно пренебречь, так как они занимают незначительную часть клеточного объема. Поступающие в цитоплазму такой клетки ионы Na+ по градиенту электрохимического потенциала Δ 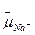 т.е. пассивно, откачиваются обратно в окружающий клетку раствор. Ионные насосы, экспортирующие Na+, локализованы в этом случае в ПМ.
т.е. пассивно, откачиваются обратно в окружающий клетку раствор. Ионные насосы, экспортирующие Na+, локализованы в этом случае в ПМ.
Клетки высших растений (за исключением меристематических), многоклеточных морских водорослей (макрофитов) и некоторых одноклеточных водорослей имеют крупную центральную вакуоль. Помимо экспорта Na+ из цитоплазмы в наружную среду они могут осуществлять активный транспорт этого иона в вакуоль, что приводит к генерации Δ 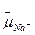 также и на тонопласте (рис. 8.16, Б). Необходимо отметить, что физиологическая роль Na+-нacoca тонопласта и осуществляемого им активного переноса Na+ в вакуоль не сводится к поддержанию низких концентраций Na+ в цитоплазме. Натриевый насос тонопласта обеспечивает также накопление Na+ в вакуоли, благодаря чему повышается осмотическое давление вакуолярного сока. Это в свою очередь вносит вклад в формирование градиента водного потенциала между окружающим клетку раствором и клеткой и обеспечивает таким образом ток воды, направленный внутрь клетки. Особенно ярко выражена двойная физиологическая роль активного транспорта Na+ через тонопласт у соленакапливающих галофитов. Примерами могут служить S. еиrораеа, сведа высокая (Suaeda altissima), К. prostrata и др. Этим растениям в условиях экстремально высоких концентраций Na+ в почвенном растворе приходится не только поддерживать цитоплазматичес-кие концентрации Na+ на нетоксическом уровне, но и решать задачу поглощения корнями воды из почвенного раствора, водный потенциал которого за счет растворенных солей может достигать -5 МПа и меньше. Эти растения для поддержания водного потенциала в клетках на более низком уровне, чем в почвенном растворе, аккумулируют Na+ и С1
также и на тонопласте (рис. 8.16, Б). Необходимо отметить, что физиологическая роль Na+-нacoca тонопласта и осуществляемого им активного переноса Na+ в вакуоль не сводится к поддержанию низких концентраций Na+ в цитоплазме. Натриевый насос тонопласта обеспечивает также накопление Na+ в вакуоли, благодаря чему повышается осмотическое давление вакуолярного сока. Это в свою очередь вносит вклад в формирование градиента водного потенциала между окружающим клетку раствором и клеткой и обеспечивает таким образом ток воды, направленный внутрь клетки. Особенно ярко выражена двойная физиологическая роль активного транспорта Na+ через тонопласт у соленакапливающих галофитов. Примерами могут служить S. еиrораеа, сведа высокая (Suaeda altissima), К. prostrata и др. Этим растениям в условиях экстремально высоких концентраций Na+ в почвенном растворе приходится не только поддерживать цитоплазматичес-кие концентрации Na+ на нетоксическом уровне, но и решать задачу поглощения корнями воды из почвенного раствора, водный потенциал которого за счет растворенных солей может достигать -5 МПа и меньше. Эти растения для поддержания водного потенциала в клетках на более низком уровне, чем в почвенном растворе, аккумулируют Na+ и С1  в вакуолях до концентраций
в вакуолях до концентраций
1,0-1,5 М.
8.3.3.1. Поступление Na+ и С1  в клетки корня из почвенного раствора
в клетки корня из почвенного раствора
Ионы поступают в цитоплазму клеток эпидермиса и коры корня из почвенного раствора по градиенту электрохимического потенциала. Градиент электрохимического потенциала иона j выражается соотношением
Δ 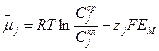 (8.1)
(8.1)
где R — газовая постоянная; Т— абсолютная температура; F— число Фарадея; 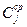 — концентрация иона j в почвенном растворе;
— концентрация иона j в почвенном растворе; 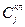 — концентрация иона j в цитоплазме; Zj — элементарный заряд иона j; ЕM — трансмембранный электрический потенциал.
— концентрация иона j в цитоплазме; Zj — элементарный заряд иона j; ЕM — трансмембранный электрический потенциал.
При высокой солености среды 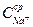 >
> 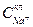 , поэтому концентрационная составляющая градиента электрохимического потенциала Na+ положительна, т. е. направлена из почвенного раствора в клетку. Член, отражающий электростатические взаимодействия, в уравнении (8.1) стоит со знаком «минус». Так как ЕM отрицателен («минус» внутри клетки) и
, поэтому концентрационная составляющая градиента электрохимического потенциала Na+ положительна, т. е. направлена из почвенного раствора в клетку. Член, отражающий электростатические взаимодействия, в уравнении (8.1) стоит со знаком «минус». Так как ЕM отрицателен («минус» внутри клетки) и 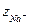 равен +1, выражение
равен +1, выражение
(- 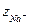 FEM) в уравнении (8.1) также принимает положительное значение. Это означает, что и электрическая составляющая градиента Δ
FEM) в уравнении (8.1) также принимает положительное значение. Это означает, что и электрическая составляющая градиента Δ 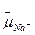 тоже является движущей силой переноса Na+ из среды в цитоплазму. При отсутствии засоления, когда концентрация Na+ в почвенном растворе не превышает 1 мМ, в жидкой среде цитоплазмы она может достигать нескольких мМ, т.е.
тоже является движущей силой переноса Na+ из среды в цитоплазму. При отсутствии засоления, когда концентрация Na+ в почвенном растворе не превышает 1 мМ, в жидкой среде цитоплазмы она может достигать нескольких мМ, т.е.
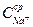 <
< 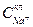 . Концентрационный член в уравнении (8.1) в этом случае становится отрицательным, однако за счет электрической составляющей градиент электрохимического потенциала Na+ в целом может оказаться положительным, означая, что и в отсутствие засоления Na+ будет пассивно поступать в клетки.
. Концентрационный член в уравнении (8.1) в этом случае становится отрицательным, однако за счет электрической составляющей градиент электрохимического потенциала Na+ в целом может оказаться положительным, означая, что и в отсутствие засоления Na+ будет пассивно поступать в клетки.
Ион хлора несет отрицательный заряд (z 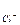 = -1), поэтому электрическая составляющая его электрохимического градиента Δ
= -1), поэтому электрическая составляющая его электрохимического градиента Δ 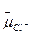 всегда направлена из клетки в среду. Другими словами, отрицательный внутри клетки ЕM создает препятствие для входа С1
всегда направлена из клетки в среду. Другими словами, отрицательный внутри клетки ЕM создает препятствие для входа С1  в цитоплазму. Отсюда следует, что только концентрационная составляющая электрохимического градиента С1
в цитоплазму. Отсюда следует, что только концентрационная составляющая электрохимического градиента С1  может обеспечить пассивное поступление С1
может обеспечить пассивное поступление С1  в клетки корня. Необходимые для этого условия создаются при засолении почвы хлористым натрием. При этом
в клетки корня. Необходимые для этого условия создаются при засолении почвы хлористым натрием. При этом 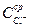 >
> 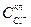 и концентрационный член RTln
и концентрационный член RTln 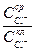 положителен. Противодействие для входа С1
положителен. Противодействие для входа С1  в клетки со стороны отрицательного внутри электрического потенциала в этих условиях ослабляется
в клетки со стороны отрицательного внутри электрического потенциала в этих условиях ослабляется
NaCl-индуцированной деполяризацией плазмалеммы (ПМ).
Скорости поступления иона j (его потоки) в цитоплазму из наружной среды и вакуоли (рис. 8.16, Б) прямо пропорциональны движущим силам (Δ 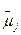 ) и коэффициентам ионной проницаемости плазмалеммы и тонопласта (Рj). Уравнение (8.2), известное как уравнение потока Гольдмана, связывает поток иона j (Jj) через мембрану (количество иона j, переносимое через единицу площади мембраны в единицу времени) с концентрационной и электрической составляющими Δ
) и коэффициентам ионной проницаемости плазмалеммы и тонопласта (Рj). Уравнение (8.2), известное как уравнение потока Гольдмана, связывает поток иона j (Jj) через мембрану (количество иона j, переносимое через единицу площади мембраны в единицу времени) с концентрационной и электрической составляющими Δ 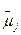 , а также с Pj:
, а также с Pj:
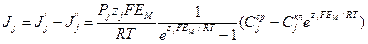
где J 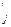 — приток иона в клетки; J
— приток иона в клетки; J 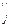 — его отток; их разность составляет суммарный поток Jj; Pj — коэффициент проницаемости мембраны для иона j.
— его отток; их разность составляет суммарный поток Jj; Pj — коэффициент проницаемости мембраны для иона j.
Анализ уравнения (8.2) приводит к важному практическому выводу, что ионная проницаемость мембран в значительной мере определяет степень солеустойчивости растительного организма, поскольку концентрация того или иного иона в цитоплазме, а, следовательно, и сила его токсического действия в значительной степени зависит от пассивного потока этого иона через мембрану из среды в клетку. Исследования транспорта Na+ через ПМ на модельной системе одноклеточных микроводорослей, у которых механизмы регуляции цитоплазматических концентраций Na+ находятся в основном в ПМ, показали, что Р 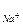 плазмалеммы тем ниже, чем выше концентрация NaCl в среде обитания, т.е. чем выше устойчивость организма к соли (табл. 8.1).
плазмалеммы тем ниже, чем выше концентрация NaCl в среде обитания, т.е. чем выше устойчивость организма к соли (табл. 8.1).
У Dunaliella salina, обитающей в водоемах с предельно высоким содержанием NaCl и способной осуществлять жизненный цикл даже в насыщенном растворе NaCl, Р 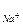 на два порядка ниже, чем у пресноводной водоросли Chlorella pyrenoidosa и приближается к Р
на два порядка ниже, чем у пресноводной водоросли Chlorella pyrenoidosa и приближается к Р 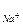 искусственных липидных пленок. При акклимации Ch. pyrenoidosa к среде, содержащей 340 мМ NaCl, Р
искусственных липидных пленок. При акклимации Ch. pyrenoidosa к среде, содержащей 340 мМ NaCl, Р  ПМ снижался почти на порядок, свидетельствуя о том, что NaCl индуцирует перестройки в химическом составе и микроструктуре мембраны, направленные на ограничение ионных потоков в цитоплазму при высокой солености среды.
ПМ снижался почти на порядок, свидетельствуя о том, что NaCl индуцирует перестройки в химическом составе и микроструктуре мембраны, направленные на ограничение ионных потоков в цитоплазму при высокой солености среды.
Следует отметить, что ионная проницаемость плазматической мембраны и других мембран может быстро изменяться в ответ на изменение ионного состава среды. Это связано с изменением активности ионных каналов. Измерения Р  ПМ водорослей (табл. 8.1) были проведены при постоянных концентрациях NaCl и других ионов в средах культивирования. Установленная на микроводорослях закономерность, выражающаяся в обратной корреляции между величиной Р
ПМ водорослей (табл. 8.1) были проведены при постоянных концентрациях NaCl и других ионов в средах культивирования. Установленная на микроводорослях закономерность, выражающаяся в обратной корреляции между величиной Р  и уровнем засоления среды обитания, не может быть безоговорочно перенесена на высшие растения. Организация транспорта ионов в целом растении выдвигает в отношении ионной проницаемости мембран клеток разных органов и тканей разные требования. Ответ на вопрос, как связана величина Р
и уровнем засоления среды обитания, не может быть безоговорочно перенесена на высшие растения. Организация транспорта ионов в целом растении выдвигает в отношении ионной проницаемости мембран клеток разных органов и тканей разные требования. Ответ на вопрос, как связана величина Р  той или иной мембраны с солеустойчивостью растения, осложняется тем обстоятельством, что разные виды растений, даже близкие между собой по степени солеустойчивости, имеют свои особенности организации дальнего транспорта ионов.
той или иной мембраны с солеустойчивостью растения, осложняется тем обстоятельством, что разные виды растений, даже близкие между собой по степени солеустойчивости, имеют свои особенности организации дальнего транспорта ионов.
Таблица 8.1. Коэффициент проницаемости плазматической мембраны для ионов Na+ (Р  ) у различающихся по устойчивости к NaCl водорослей (Ю.В.Балнокин, 1995)
) у различающихся по устойчивости к NaCl водорослей (Ю.В.Балнокин, 1995)

8.3.3.2. Транспортные белки плазматической мембраны, вовлеченные в перенос Na+ и Сl  из наружной среды в цитоплазму
из наружной среды в цитоплазму
Na+ и другие ионы не проникают в клетки через липидный бислой мембраны. Вход ионов в клетки осуществляется через ионные каналы, а также с помощью переносчиков. Nа+-селективные каналы, подобные Na+-селективным каналам животных клеток, в растительных клетках не найдены. Применение электрофизиологических методов, и особенно метода регистрации токов одиночных ионных каналов (patch clamp), в сочетании с молекулярно-биологическими подходами позволило обнаружить в ПМ клеток корней несколько белков, через которые Na+ входит в клетки, и в ряде случаев идентифицировать их на молекулярно-генетическом уровне. К таким белкам относятся К+-каналы плазмалеммы, обладающие низким сродством к ионам К+ (Кт в миллимолярном диапазоне концентраций К+), низкоселективные ионные каналы и высокоаффинные переносчики К+ (Кт в микромолярном диапазоне концентраций). Ниже приведена более подробная информация об этих белках (рис. 8.17).
1. Входные (inward rectifying) К-каналы — активируются при гиперполяризации ПМ, т. е. при смещении ЕM к более отрицательным значениям. Они обнаруживают высокую K+/Na+ селективность при физиологических концентрациях К+ и Na+ в наружной среде, однако при высоких концентрациях солей натрия в среде могут вносить существенный вклад в поглощение Na+ клетками. Такие каналы обнаружены во многих растениях, их транспортные свойства хорошо изучены электрофизиологическими методами. Из корней A. thaliana выделен ген входных К+-каналов — АКТ1.
2. Выходные ( outward rectifying) К+ -каналы — активируются в ответ на деполяризацию ПМ, т. е. при смещении ЕM к более положительным значениям. При деполяризации ПМ через выходные
К+-каналы может осуществляться диффузия К+ из цитоплазмы в наружную среду. Через эти же каналы Na+ может диффундировать из среды в цитоплазму. Несколько каналов этого типа было идентифицировано на молекулярно-генетическом уровне, например, КСО1 в клетках A. thaliana. Один из них, известный как NORC, обладает слабой избирательной способностью по отношению к транспортируемым катионам и активируется возрастающими концентрациями Са2+ в цитозоле.
3. Потенциалнезависимые катионные VIC (voltage-independent channel)-каналы — обладают относительно низкой K+/Na+ селективностью и, в отличие от потенциалзависимых входных и выходных К+-каналов, не изменяют ионной проводимости при изменении трансмембранного электрического потенциала.
4. Из высокоафинных К+-транспортирующих механизмов в поглощении Na+ принимает участие НКТ1-переносчик — К+,Nа+-симпортер. Этот транспортный белок переносит два иона в одном направлении (симпорт). НКТ1 был выделен из корней пшеницы. Была показана тканcспецифическая экспрессия гена НКТ1 в клетках коры корня. Переносчики, подобные НКТ1, обнаружены также в A. thaliana и ячмене. Первоначально НКТ1 был описан как К+,Н+-симпортер, при участии которого корни осуществляют поглощение иона К+ из среды с его микромолярными концентрациями. Ионы калия при этом транспортируются в клетки за счет градиента электрохимического потенциала Н+. Позже было показано, что при высокой солености среды для энергизации поглощения К+ вместо Δ 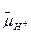 используется Δ
используется Δ 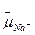 , и ионы К+ в этом случае поглощаются клетками вместе с ионами Na+.
, и ионы К+ в этом случае поглощаются клетками вместе с ионами Na+.
Исследования транспорта Na+ с помощью радиоактивного изотопа 22Na+ и электрофизиологических методов показали, что из вышеперечисленных транспортных белков ПМ наибольший вклад в поглощение Na+ клетками корней вносят VIC-каналы. Результаты этих экспериментов имеют важное практическое значение, поскольку обнаруживают одну из потенциальных молекулярных мишеней для манипуляций с геномом растений методами генетической инженерии в целях повышения солеустойчивости растений. VIC-каналы, однако, до настоящего времени не идентифицированы на молекулярно-генетическом уровне. Существенно, что Са2+, конкурируя за места связывания с Na+, блокирует VIC-каналы и ингибирует поглощение Na+ корнями. Это согласуется с известной способностью солей кальция повышать урожайность некоторых культур на засоленных почвах.
Поступление ионов С1  в клетки растений при высоких концентрациях NaCl в почвенном растворе происходит через анионные каналы ПМ по градиенту электрохимического потенциала (рис. 8.17; см. рис. 8.20). Когда наружная концентрация NaCl повышается, более быстрая диффузия в клетки Na+ по сравнению с С1
в клетки растений при высоких концентрациях NaCl в почвенном растворе происходит через анионные каналы ПМ по градиенту электрохимического потенциала (рис. 8.17; см. рис. 8.20). Когда наружная концентрация NaCl повышается, более быстрая диффузия в клетки Na+ по сравнению с С1  приводит к диссипации ЕM на ПМ. Градиент электрохимического потенциала С1
приводит к диссипации ЕM на ПМ. Градиент электрохимического потенциала С1  смещается вследствие этого к более положительному значению, способствуя пассивному входу С1
смещается вследствие этого к более положительному значению, способствуя пассивному входу С1  в клетки корня.
в клетки корня.
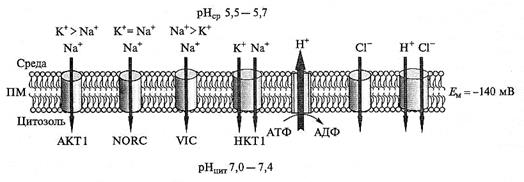
Рис. 8.17. Транспортные белки плазмалеммы (ПМ) через которые осуществляется
вход Na+ и С1  в клетки.
в клетки.
Различные К+-транспортирующие белки ПМ вовлечены в перенос Na+: входные К -каналы,
АКТ1; выходные К+-каналы, NORC; потенциалнезависимые VIC-каналы и К+,Na+-симпортер,
НКТ1. Вход С1  осуществляется через анионные каналы и Н+, С1
осуществляется через анионные каналы и Н+, С1  -симпортер, энергизуемый Δ
-симпортер, энергизуемый Δ 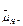 ,
,
который генерируется Н+-АТФазой. ЕM — потенциал мембраны
Анионные каналы обнаружены в мембранах высших растений, водорослей и грибов. Методом регистрации токов одиночных ионных каналов в ПМ и тонопласте растительных клеток было выявлено несколько типов каналов с различной избирательностью по отношению к анионам, разными свойствами и кинетическими характеристиками. До настоящего времени твердо не установлено, какой тип анионных каналов вовлечен в перенос С1  в клетки при почвенном засолении. В ПМ клеток корней пшеницы обнаружены анионные каналы, активирующиеся при деполяризации мембраны, а также в ответ на повышение концентрации Са2+ в цитоплазме и анионов в наружной среде. Такие условия возникают при увеличении наружной концентрации NaCl. Эти каналы относятся к группе так называемых «быстрых» анионных каналов, характеризующихся миллисекундной кинетикой транспорта С1
в клетки при почвенном засолении. В ПМ клеток корней пшеницы обнаружены анионные каналы, активирующиеся при деполяризации мембраны, а также в ответ на повышение концентрации Са2+ в цитоплазме и анионов в наружной среде. Такие условия возникают при увеличении наружной концентрации NaCl. Эти каналы относятся к группе так называемых «быстрых» анионных каналов, характеризующихся миллисекундной кинетикой транспорта С1  . Предполагается, что именно через них С1
. Предполагается, что именно через них С1  поступает в клетки корня при повышении концентрации соли в среде. На основании гомологии с С1
поступает в клетки корня при повышении концентрации соли в среде. На основании гомологии с С1  -каналами животных клеток некоторые анионные каналы идентифицированы на молекулярно-генетическом уровне, в частности CLC-Nt1 и CLC-Nt2 — в растениях табака,
-каналами животных клеток некоторые анионные каналы идентифицированы на молекулярно-генетическом уровне, в частности CLC-Nt1 и CLC-Nt2 — в растениях табака,
AtCLC-a-d — у арабидопсиса, St-CLC — у картофеля. При этом, однако, локализация, функциональные характеристики и физиологическая роль продуктов идентифицированных генов остаются нераскрытыми.
Через некоторое время после возрастания наружной концентрации соли и входа Na+ и С1  в клетки обмен веществ и ионный гомеостаз клеток переходят в новое стационарное состояние. Считается, что после достижения нового стационарного состояния и реполяризации ПМ С1
в клетки обмен веществ и ионный гомеостаз клеток переходят в новое стационарное состояние. Считается, что после достижения нового стационарного состояния и реполяризации ПМ С1  транспортируется в клетки против градиента электрохимического потенциала с помощью
транспортируется в клетки против градиента электрохимического потенциала с помощью
С1  , Н+-симпортера, который использует Δ
, Н+-симпортера, который использует Δ 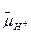 как движущую силу для входа С1
как движущую силу для входа С1  в клетки.
в клетки.
8.3.3.3. Экспорт Na+ и Сl  из цитоплазмы
из цитоплазмы
Низкие концентрации Na+ и С1  в цитоплазме при высокой солености среды поддерживаются не только за счет ограничения входных потоков этих ионов, но и благодаря их энергозависимому экспорту из цитоплазмы. Экспорт может осуществляться в двух направлениях: обратно через ПМ в экстрацеллюлярное пространство и в вакуоль через тонопласт. Ниже рассмотрены Na+ - и
в цитоплазме при высокой солености среды поддерживаются не только за счет ограничения входных потоков этих ионов, но и благодаря их энергозависимому экспорту из цитоплазмы. Экспорт может осуществляться в двух направлениях: обратно через ПМ в экстрацеллюлярное пространство и в вакуоль через тонопласт. Ниже рассмотрены Na+ - и
С1  -экспортирующие механизмы плазмалеммы и тонопласта.
-экспортирующие механизмы плазмалеммы и тонопласта.
Na+/H+-антипортер плазматической мембраны — представляет собой механизм ион-обменной диффузии, который осуществляет перенос Na+ из цитоплазмы в наружную среду в обмен на Н+ (рис. 8.18). Экспорт Na+ происходит против градиента электрохимического потенциала этого иона за счет энергии Δ 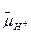 и является вторично активным видом транспорта. Генерация Δ
и является вторично активным видом транспорта. Генерация Δ 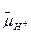 осуществляется Н+-АТФазой ПМ. На функциональном уровне Nа+/Н+-антипортер обнаружен в ПМ высших растений, водорослей и дрожжей. Недавно ген SOS1, кодирующий Na+/H+-aнтипортер ПМ, выделен из A. thaliana.
осуществляется Н+-АТФазой ПМ. На функциональном уровне Nа+/Н+-антипортер обнаружен в ПМ высших растений, водорослей и дрожжей. Недавно ген SOS1, кодирующий Na+/H+-aнтипортер ПМ, выделен из A. thaliana.
Первичный Na+-нacoc (Na-АТФаза). В плазматической мембране некоторых дрожжей и галотолерантных водорослей обнаружен первичный Na+-нacoc, который является
Na+-транспортирующей АТФазой (рис. 8.18).
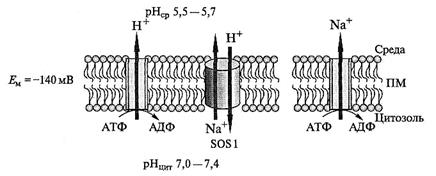
Рис. 8.18. Экспорт Na+ из цитоплазмы в наружную среду.
Перенос Na+ в среду осуществляется Nа+/Н+-антипортером плазмалеммы (SOS1) против градиента электрохимического потенциала. Источником энергии для переноса Na+ является Δ 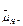 , генерируемый Н+-АТФазой плазмалеммы (ПМ). В плазмалемме некоторых водорослей и грибов наряду с Na/Н+-антипортером и Н+-АТФазой функционирует первичный Na+-нacoc, которым является Nа+-транспортирующая АТФаза
, генерируемый Н+-АТФазой плазмалеммы (ПМ). В плазмалемме некоторых водорослей и грибов наряду с Na/Н+-антипортером и Н+-АТФазой функционирует первичный Na+-нacoc, которым является Nа+-транспортирующая АТФаза
Na+-АТФазы транспортируют Na+ из цитоплазмы в наружную среду за счет энергии фосфатных связей АТФ. Эти ферменты относятся к семейству АТФаз Р-типа, образующих в каталитическом цикле фосфорилированный интермедиат. Na+-АТФаза из дрожжей S. cerevisiae исследована на молекулярно-генетическом уровне. Экспрессия гена ENA1, кодирующего Na+-АТФазу из этого организма, существенно стимулирует экспорт Na+, а также Li+ из цитоплазмы и вносит заметный вклад в солеустойчивость этого организма. Nа+-АТФазы из галотолерантных водорослей подробно исследованы на функциональном уровне. Установлено, что Na+ -АТФаза Tetraselmis viridis осуществляет перенос Na+ в обмен на Н+, тогда как фермент из Heterosigma akashivo по своим свойствам близок Nа+,К+-АТФазе животных клеток. Подобного рода Nа+-транспортирующие АТФазы в клетках высших растений не обнаружены.
Na/H-антипортер тонопласта. Подобно тому, как Nа+/Н+-антипортер плазмалеммы переносит Na+ из цитоплазмы в экстрацеллюлярное пространство, снижая цитоплазматические концентрации Na+, Na+/Н+-антипортер тонопласта переносит Na+ в вакуоль, выполняя ту же самую физиологическую функцию (рис. 8.19). Наряду с Nа+/Н+-антипортером тонопласта ключевым транспортным механизмом в этом процессе является локализованная в тонопласте Н+-АТФаза. Напомним, что последняя относится к АТФазам V-типа, ее функция состоит в переносе Н+ из цитоплазмы в вакуоль и генерации таким образом Δ 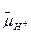 на тонопласте. В генерации на тонопласте Δ
на тонопласте. В генерации на тонопласте Δ 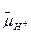 принимает участие также Н+-транспортирующая пирофосфатаза этой мембраны.
принимает участие также Н+-транспортирующая пирофосфатаза этой мембраны.
Nа+/Н+-антипортер и Н+-АТФаза тонопласта играют чрезвычайно важную роль в солеустойчи-вости высших растений, так как образуют у них главную систему экспорта Na+ из цитоплазмы. Как детерминанты солеустойчивости они привлекают особое внимание исследователей. Использование молекулярно-биологических подходов позволило идентифицировать ген
Nа+/Н+-антипортера тонопласта (AtNHX) в A. thaliana.

Рис. 8.19. Депонирование Na+ в вакуоли.
Транспорт Na+ в вакуоль осуществляется Nа+/Н+-антипортером тонопласта (NHX) против градиента электрохимического потенциала. Источником энергии для переноса Na+ является Δ 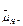 , генерируемый Н+-АТФазой и Н+-пирофосфатазой (ФФН) тонопласта (Т). Через катионные каналы тонопласта, характеризующиеся низкой избирательной способностью, происходит утечка Na+ из вакуоли в цитоплазму
, генерируемый Н+-АТФазой и Н+-пирофосфатазой (ФФН) тонопласта (Т). Через катионные каналы тонопласта, характеризующиеся низкой избирательной способностью, происходит утечка Na+ из вакуоли в цитоплазму
Системы экспорта С1  , локализованные в плазматической мембране и тонопласте. При солевом стрессе поступающие в клетки корня ионы С1
, локализованные в плазматической мембране и тонопласте. При солевом стрессе поступающие в клетки корня ионы С1  , так же как ионы Na+, должны выводиться назад в экстрацеллюлярное пространство или депонироваться в вакуолях (рис. 8.20).
, так же как ионы Na+, должны выводиться назад в экстрацеллюлярное пространство или депонироваться в вакуолях (рис. 8.20).
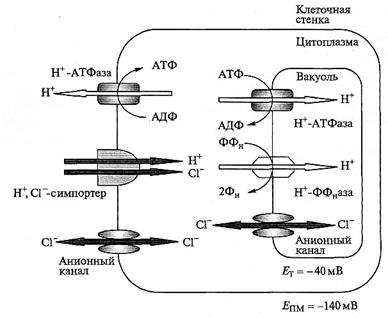
Рис. 8.20. Транспортные белки плазмалеммы и тонопласта, вовлеченные в поглощение
и экспорт С1  в клетках растений.
в клетках растений.
Перенос С1  через плазмалемму (ПМ) и тонопласт (Т) осуществляется через анионные каналы. Направление движения С1
через плазмалемму (ПМ) и тонопласт (Т) осуществляется через анионные каналы. Направление движения С1  (в цитоплазму или из цитоплазмы) определяется направлением градиентов электрохимических потенциалов С1
(в цитоплазму или из цитоплазмы) определяется направлением градиентов электрохимических потенциалов С1  на этих мембранах. При солевом стрессе происходит NaCl-индуцированная деполяризация ПМ. В этих условиях градиент электрохимического потенциала С1
на этих мембранах. При солевом стрессе происходит NaCl-индуцированная деполяризация ПМ. В этих условиях градиент электрохимического потенциала С1  (Δ
(Δ 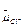 ) на ПМ направлен из наружной среды в цитоплазму и С1
) на ПМ направлен из наружной среды в цитоплазму и С1  поступает в клетки. При отсутствии засоления С1
поступает в клетки. При отсутствии засоления С1  может поглощаться клеткой с помощью Н+, С1
может поглощаться клеткой с помощью Н+, С1  -симпортера, использующего для этого Δ
-симпортера, использующего для этого Δ 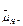 как движущую силу. Экспорт С1
как движущую силу. Экспорт С1  из цитоплазмы через анионные каналы происходит при гиперполяризации ПМ и тонопласта. Гиперполяризация происходит при включении Н+-АТФаз ПМ и тонопласта, а также Н+-ФФназы тонопласта. При гиперполяризации градиент электрохимического потенциала С1
из цитоплазмы через анионные каналы происходит при гиперполяризации ПМ и тонопласта. Гиперполяризация происходит при включении Н+-АТФаз ПМ и тонопласта, а также Н+-ФФназы тонопласта. При гиперполяризации градиент электрохимического потенциала С1  на этих мембранах приобретает такое направление, что СГ транспортируется из цитоплазмы в наружную среду и вакуоль
на этих мембранах приобретает такое направление, что СГ транспортируется из цитоплазмы в наружную среду и вакуоль
Экспорт С1  из цитоплазмы через ПМ или тонопласт, как и его вход, происходит через анионные каналы. Направление движения ионов С1
из цитоплазмы через ПМ или тонопласт, как и его вход, происходит через анионные каналы. Направление движения ионов С1  (вход в цитоплазму или выход из нее) определяется направлением градиентов электрохимических потенциалов С1
(вход в цитоплазму или выход из нее) определяется направлением градиентов электрохимических потенциалов С1  на ПМ и тонопласте. В связи с этим Н+-АТФаза ПМ, Н+-АТФаза тонопласта и Н+-пирофосфатаза тонопласта — генераторы электрических потенциалов на этих мембранах (минус на цитоплазматической стороне для обеих мембран) — играют важнейшую роль в экспорте С1
на ПМ и тонопласте. В связи с этим Н+-АТФаза ПМ, Н+-АТФаза тонопласта и Н+-пирофосфатаза тонопласта — генераторы электрических потенциалов на этих мембранах (минус на цитоплазматической стороне для обеих мембран) — играют важнейшую роль в экспорте С1  из цитоплазмы. Включаясь, эти транспортные белки приводят к гиперполяризации ПМ и тонопласта и соответственно к изменению электрохимического градиента ионов С1
из цитоплазмы. Включаясь, эти транспортные белки приводят к гиперполяризации ПМ и тонопласта и соответственно к изменению электрохимического градиента ионов С1  , так что последние транспортируются из цитоплазмы наружу и в вакуоль. Предполагают, что анионные каналы, осуществляющие экспорт С1
, так что последние транспортируются из цитоплазмы наружу и в вакуоль. Предполагают, что анионные каналы, осуществляющие экспорт С1  , активируются в ответ на гиперполяризацию мембран. Эти анионные каналы до настоящего времени остаются неизученными.
, активируются в ответ на гиперполяризацию мембран. Эти анионные каналы до настоящего времени остаются неизученными.
8.3.3,4. К+/Nа+-селективность — индикатор солеустойчивости растений
Калий как макроэлемент необходим для роста и развития всех растений. Напротив, натрий важен для сравнительно небольшого числа видов. Во всех живых клетках цитоплазматические концентрации К+ относительно велики, тогда как концентрации Na+ относительно низкие. У растений концентрации К+ в цитоплазме составляют от нескольких десятков до 200 ммоль/кг, тогда как концентрации Na+ не превышают нескольких ммоль/кг, а чаще составляют несколько сот мкмоль/кг. В почвенном растворе К+ и Na+ конкурируют за поглощение клетками корня. Эта конкуренция может иметь серьезные негативные последствия для растений при засолении, когда концентрация Na+ в почвенном растворе существенно превышает концентрацию К+. В связи с этим способность клеток сохранять высокое отношение K+/Na+ в цитоплазме при высокой солености среды рассматривают как одно из свидетельств высокой солеустойчивости растения. Низкие концентрации Na+ и высокие концентрации К+ в животных клетках поддерживаются благодаря функции Na+, К+-АТФазы. В цитоплазме клеток растений преимущественное содержание К+ по сравнению с содержанием Na+ в нормальных условиях обусловлено, во-первых, ионной избирательностью транспортных систем ПМ, через которые К+ и Na+ проникают в клетки, и, во-вторых, экспортом Na+ (но не К+) из цитоплазмы. При высокой солености среды сниженная активность ионных каналов и переносчиков, через которые Na+ поступает в клетки, и повышенная активность систем, экспортирующих Na+, могли бы затормозить накопление Na+ в цитоплазме и этим повысить K+/Na+ отношение. Активность и/или количество молекул этих белков в расчете на единицу площади мембраны определяют отношение K+/Na+ в цитоплазме.
Как отмечалось выше, VIC-каналы ПМ — главные «ворота» для входа Na+ в клетки корня при засолении, однако о регуляции активности VIC-каналов известно очень мало. Некоторая информация имеется по поводу регуляции активности систем, экспортирующих Na+ из цитоплазмы. Показано, что у A. thaliana экспрессия генов S0S1 и AtNHX, кодирующих Nа+/Н+-антипортеры ПМ и тонопласта соответственно, возрастает в ответ на внесение в почву NaCl. Мутации по S0S1 делали растения чувствительными к NaCl. Известно также, что
при действии на растение NaCl возрастает активность Н+-АТФаз ПМ и тонопласта. NaCl-индуцированная стимуляция активности АТФаз происходит за счет увеличения числа молекул фермента в мембранах.
 2015-06-14
2015-06-14 999
999








