| Опыт 1. Тепловые эффекты при растворении |
| 1.1. В пробирку с 5 мл воды (измерьте заранее ее температуру t0 = _______°С) внесите немного твердого NaOH (или КОН), помешайте стеклянной палочкой и отметьте изменение температуры (t = _______°С). |
| 1.2. Проведите аналогичный опыт с NH4NO3 (к) (t = __________°С). |
| Опыт 2. Изменение температуры замерзания и температуры кипения растворов |
| 2.1. Две пробирки наполните наполовину: одну водой, другую – 10%-ным раствором NaCl. Поместите их в стакан с охладительной смесью (лед с солью) и отметьте температуру замерзания Н2О (tзам = __________°С) и раствора NaCl (tзам =__________°С). |
| 2.2. Две пробирки наполните наполовину водой, а одну из них внесите 1 г СаСl2. Нагрейте до кипения и измерьте температуру кипения Н2О (tкип = _________°С) и раствора СаСl2 (tкип = __________°С). |
| Опыт 3. Приготовление растворов с определенной массовой долей из твердого вещества и воды |
Задание: I вариант – приготовьте 50 г раствора NaCl с массовой долей вещества в растворе 5%; II вариант – приготовьте 50 г раствора NaCl с массовой долей вещества в растворе 3%.
Расчитайте массу NaCl, необходимого для приготовления 50 г 5%-ного (или 3%) раствора NaCl по формуле вычисления массовой доли:
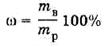 Масса воды, необходимая для приготовления 50 г 5%-ного (или 3%) раствора NaCl:
m(H2O) = m(раствора) – m(соли)
Взвесьте на технических весах необходимое количество соли, отмерьте мерным цилиндром нужный объем воды и растворите приготовленную соль. Затем налейте в цилиндр 40 мл полученного раствора NaCl и измерьте плотность ареометром, сравните ее с данными таблицы. Плотность полученного раствора составляет __________ г/мл. После измерения ареометр промойте водой, осторожно вытрете досуха и поставьте в набор. Рассчитайте молярность и нормальность полученного раствора.
Масса воды, необходимая для приготовления 50 г 5%-ного (или 3%) раствора NaCl:
m(H2O) = m(раствора) – m(соли)
Взвесьте на технических весах необходимое количество соли, отмерьте мерным цилиндром нужный объем воды и растворите приготовленную соль. Затем налейте в цилиндр 40 мл полученного раствора NaCl и измерьте плотность ареометром, сравните ее с данными таблицы. Плотность полученного раствора составляет __________ г/мл. После измерения ареометр промойте водой, осторожно вытрете досуха и поставьте в набор. Рассчитайте молярность и нормальность полученного раствора.
|
| Опыт 4. Приготовление раствора заданной концентрации из более концентрированного раствора и воды |
| Задание: I вариант – приготовьте 50 мл 0,1 М раствора H2SO4 (или HCl) из раствора, имеющегося в лаборатории; II вариант – приготовьте 50 мл 0,2 М раствора H2SO4 (или HCl) из раствора, имеющегося в лаборатории. Измерите плотность исходного раствора кислоты ареометром (ρ =_________г/мл). По табличным данным определите массовую долю кислоты (ω = __________%), соответствующую найденной плотности раствора. Рассчитайте, какое весовое количество этой кислоты нужно для приготовления 50 мл 0,1 М раствора, а затем пересчитайте полученную величину на объем: 1) найдем, сколько граммов вещества кислоты содержится в 50 мл 0,1 М раствора исходя из формулы: СM = m(в-ва) / M(в-ва) • V(р-ра) 2) найдем массу исходного раствора кислоты исходя из формулы: ω = m(в-ва) • 100% / m(р-ра) 3) найдем объем раствора по формуле V = m / ρ Отмерьте маленьким цилиндром (или градуированной пипеткой) рассчитанный объем исходного раствора H2SO4 и вылейте его в мерную колбу с небольшим количеством воды, а затем доведите уровень воды (по каплям) до метки 50 мл. Перемешайте раствор. Расчет молярной концентрации (молярности) полученного раствора (моль/л): ____________________________________________________________________________ Расчет нормальной концентрации полученного раствора (моль/л): ____________________________________________________________________________ В следующем опыте установите концентрацию полученного раствора H2SO4 титрованием 0,1 М раствором NaOH. |
| Опыт 5. Титрование | ||||||||||
Заполните бюретку до нулевой отметки титрованным 0,1 М раствором NaOH. Налейте в коническую колбу пипеткой 10 мл раствора серной кислоты, полученного в предыдущем опыте, и добавьте 2–3 капли фенолфталеина.
Под бюреткой на белый лист бумаги поставьте коническую колбу с раствором кислоты так, чтобы носик бюретки входил внутрь колбы, а шарик в резиновом шланге находился немного выше горла колбы. Приливайте небольшими порциями раствор щелочи к раствору кислоты при непрерывном перемешивании раствора в колбе. Титруйте до появления устойчивой розовой окраски, не исчезающей в течение 30 с.
Запишите объем израсходованного раствора щелочи с точностью до 0,1 мл положение уровня раствора в бюретке.
Титрование повторите 3 раза. Объемы израсходованной щелочи не должны отличаться больше чем на 0,2 мл (в расчетах используйте среднее значение).
Рассчитайте нормальность раствора кислоты по формуле: V1 / V2 = CH2 / CH1 Пересчитайте нормальность кислоты на молярность. Высчитайте процент ошибки по формуле: П = (СМ теор – СМ пр)∙100% / СМ теор |
 2015-06-14
2015-06-14 378
378








