Лекция 3 (1)
Список рекомендуемых источников:
1. Васильев В.П. Аналитическая химия: В 2 кн.: Кн. 1: Титриметрические и гравиметрические методы анализа: учеб. для студ. вузов, обучающихся по химико-технол. спец. – 4-е изд., стереотип. – М.: Дрофа, 2004. – 368 с. (С. 49 – 67).
2. Основы аналитической химии: В 2 кн.: Кн. 1: Общие вопросы. Методы разделения: учеб. для вузов / Ю.А. Золотов, Е.Н. Дорохова, В.И. Фадеева и др. Под ред. Ю.А. Золотова. – 2-е изд., перераб. и доп. – М.: Высш. шк., 2000. – 351 с. (С. 96 – 116).
Большая часть химических реакций, которые применяются в гравиметрическом, титриметрическом и других физико-химических методах анализа, протекают в растворе.
Раствор – это гомогенная система переменного состава, образованная, как минимум, 2 компонентами, один из которых является растворителем.
Как правило, за растворитель принимают количественно наибольшую составную часть раствора.
Различают газообразные, жидкие и твердые растворы.
Для образования жидкого раствора в качестве растворителя применяют воду или различные органические жидкости (спирты, эфиры, углеводороды и др.), а также аммиак, серную кислоту и др.
Важной характеристикой раствора является его состав или концентрация компонентов.
Массовая доля (w) – это отношение массы растворенного вещества к общей массе раствора, выраженное в процентах.
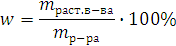
Мольная доля (Ni) – это отношение количества растворенного вещества (растворителя) к общему количеству вещества, находящихся в растворе, выраженное в процентах.
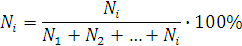
Молярная концентрация (молярность) (СМ) – это отношение количества растворенного вещества к объему раствора.
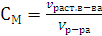 , [моль/л]
, [моль/л]
Моляльная концентрация (моляльность) (m) – это отношение количества растворенного вещества к массе растворителя (в кг).
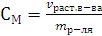 , [моль/кг]
, [моль/кг]
Эквивалентная концентрация (нормальность) – это отношение числа эквивалентов растворенного вещества к объему раствора.
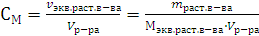 , [моль/л]
, [моль/л]
Титр – это отношение массы растворенного вещества к объему раствора (в мл).
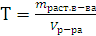 , [г/мл]
, [г/мл]
Общую (аналитическую, валовую) концентрацию вещества X в растворе обозначают как с°(Х), которая представляет собой молярную концентрацию растворенного вещества независимо от того, какие превращения оно претерпело при растворении (диссоциация, гидролиз и т.д.).
Например, в водном растворе щавелевой кислоты содержатся продукты ее ступенчатой диссоциации:
Н2С2О4 = Н+ + НС2О4-
HC2O4- = H+ + C2O42-
Хотя часть молекул щавелевой кислоты продиссоциировала, это не отразилось на общей или аналитической концентрации кислоты – она осталась равной с°(Н2С2О4) моль/л.
Когда процессы взаимодействия растворенного вещества и растворителя, а также растворенных частиц между собою придут в состояние равновесия и концентрации с течением времени изменяться не будут, в растворе устанавливаются равновесные концентрации.
Обозначают равновесную концентрацию как с, или используют квадратные скобки [ ], в которые заключается формула соединения.
В растворе устанавливается равновесие между всеми формами существования вещества. Равновесные и общая концентрации частиц в растворе связаны уравнением материального баланса.
Например, в растворе щавелевой кислоты в соответствии вышеприведенными уравнениями уравнение материального баланса имеет вид:
с°(Н2С2О4) = [Н2С2О4] + [НС2О4-] + [С2О42-].
На форму существования элемента в данном растворе влияет его собственная природа и состав системы. Если степень окисления элемента +4 и выше, то в водных растворах он присутствует в виде комплексных ионов или в форме анионов.
В водных растворах вода проявляет себя активным компонентом системы в силу своих свойств. Молекула имеет нелинейную структуру, общее электронное облако смещено к атому кислорода как наиболее ЭО элементу. Это обеспечивает дипольный момент молекулы. Образование водородной связи между молекулами воды приводит к образованию упорядоченной структуры. Наличие свободной неподеленной пары у атома кислорода позволяет воде участвовать в качестве лиганда в процессе комплексообразования.
Растворение веществ в воде следует отнести к сложным физико-химическим процессам. Оно сопровождается тепловым эффектом, нарушением структуры растворителя, приводит к образованию новых веществ – гидратов, аквакомплексов, гидроксокомплексов. Катионы обычно гидратированы сильнее анионов. Степень гидратации иона увеличивается с уменьшением его радиуса и повышением заряда. Подвижность иона и активность, с которой он проявляет себя в химических реакциях, ослабевает. В концентрированных растворах возможны процессы: ассоциации частиц, образования ионных пар и т.д.
Катионы, проявляющие свойства комплексообразователей, присутствуют в водных растворах в форме аквакомплексов: [Со(Н2О)6]2+, [Cu(H2O)6]2+, [Fe(H2O)6]3+ и т.д.
Изменение кислотности растворов приводит к образованию гидроксокомплексов:
[Al(H2O)6]3+ + HOH ↔ [Al(H2O)5OH]2+ + H3O+
Следовательно, вода активный компонент системы, влияющий на ионное состояние растворенного вещества.
Один и тот же элемент может присутствовать в нескольких степенях окисления, каждая из которых в свою очередь, может быть представлена несколькими ионными формами:
Cr (III): [Cr(H2O)6]3+, [Cr(H2O)5OH]2+, [Cr(OH)6]3-.
Одна из указанных форм может переходить в другую при изменении условий реакции.
Пример: образование аквакомплексов меди
1) CuCl2 (50 г) – изумрудно-зеленого цвета;
2) CuCl2 + Н2О (50 мл) – зелено-голубой цвет раствора: [CuCl4]2-, [Cu(H2O)6]2+;
3) CuCl2 + Н2О (200 мл) – зелено-голубой цвет раствора: [Cu(H2O)6]2+.
Следовательно, если система многокомпонентна, то форма существования элемента в ней зависит:
- от природы самого элемента и растворителя;
- от состава системы в целом, в первую очередь, от ее кислотности и наличия лигандов.
В идеальном случае принимают, что элемент присутствует в одной ионной форме, а межионные взаимодействия так малы, что не учитываются. Это случай очень разбавленных растворов индивидуального вещества, которое находится полностью в диссоциированном состоянии и не вступает в химическое взаимодействие с растворителем.
В этом случае, а (А) = [А] = с 0(А).
Поведение веществ в реальных условиях определяется его природой и концентрацией, природой растворителя и наличием посторонних веществ, изменяющих ионную силу раствора и вызывающих конкурирующие реакции.
Растворы электролитов имеют более низкую температуру замерзания, повышенное осмотическое давление. Измерение электропроводности растворов приводит к заключению о неполной диссоциации электролитов. Степень диссоциации обычно определяют по электропроводности раствора, которая зависит не только от степени диссоциации, но и от скорости движения ионов в растворе. Данное количество ионов перенесет при прочих равных условиях тем больше электричества, чем быстрее эти ионы движутся.
Теория Аррениуса объясняет, что скорость движения ионов определяется лишь природой ионов и не зависит от концентрации растворов.
Теория сильных электролитов учитывает электростатическое взаимодействие между ионами. Поскольку ионы несут заряды, то каждый ион притягивает противоположно заряженный и отталкивает одноименный. Это приводит к уменьшению скорости движения ионов, причем тем сильнее, тем ближе ионы находятся друг к другу, т.е. чем выше концентрация раствора. Возрастание эквивалентной электропроводности с разбавлением раствора теория сильных электролитов объясняет не увеличением степени диссоциации электролита, а возрастанием скорости движения ионов, вследствие разряжения ионной атмосферы и уменьшения межионных сил. Ионы, находящиеся в растворе, не способны в полной мере к химическим реакциям, вследствие мешающего влияния ассоциатов и ионной сферы. Поэтому эффективная концентрация ионов, вступающих в реакцию, меньше их истинной концентрации в растворе.
Для учета влияния ионной атмосферы Льюис ввел в 1901 г понятие «активность ионов», которая описывает их эффективную концентрацию в растворе. Активность учитывает взаимное притяжение ионов, взаимодействие растворенного вещества с растворителем.
Активность ионов (а) – это та эффективная кажущаяся концентрация иона, соответственно которой он действует в химических реакциях.
Взаимосвязь истинной концентрации и активности ионов выражается следующим образом:
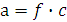 ,
,
где f – коэффициент активности, равный отношению активности к общей молярной концентрации иона.
Активность иона всегда меньше его истинной концентрации.
При разбавлении раствора вследствие ослабления межионных взаимодействий активность ионов приближается к величине их истинной концентрации, а значение f к 1.
Величина f зависит не только от концентрации ионов данного электролита, но и от концентрации всех посторонних ионов, присутствующих в растворе. Она понижается с возрастанием ионной силы раствора (m).
Ионная сила (m) – это величина, равная полусумме произведений концентраций ионов (с), присутствующих в растворе, на квадраты их зарядов.
m = ½ (с1z12 + c2z22 + … + cnzn2)
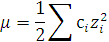
При малом значении ионной силы раствора (m£0,05), коэффициент активности f связан с m раствора формулой Дебая-Хюккеля:
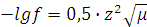
При более концентрированных растворах, когда m£0,1, следует:
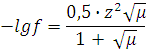
Для электролитов состава Kt+An-: m = с.
Для электролитов состава KtAn2: m = 3с.
Для электролитов состава Kt2An: m = 3с.
Для электролитов состава Kt2+An2-: m = 4с.
Для электролитов состава Kt3An: m = 6с.
 2015-06-14
2015-06-14 4455
4455