Лабораторная работа № 4
Цель работы: Изучение физико-химической природы процесса растворения, свойств растворов, освоение навыков приготовления растворов заданной концентрации и методики их количественного анализа.
Теория: Истинные растворы и механизм процесса растворения. Классификация растворов. Растворимость. Влияние различных факторов на растворимость. Тепловые эффекты при растворении. Насыщенные и ненасыщенные растворы. Произведение растворимости. Условия образования и растворения осадков. Концентрация растворов, способы ее выражения.
Раствор – гомогенная система переменного состава, состоящая из двух или более компонентов и находящаяся в состоянии химического равновесия.
Согласно закону Рауля: относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного нелетучего вещества.
Присутствие растворенного вещества, наряду с понижением давления насыщенного пара над раствором, повышает температуру кипения и понижает температуру замерзания.
В соответствии с законом Рауля, и повышение температуры кипения, и понижения температуры замерзания растворов по сравнению с чистым растворителем (Δt), пропорциональны моляльной концентрации растворенного вещества: Δt = К ∙ С m, где К – коэффициент пропорциональности; Ст – моляльность раствора.
Методы криоскопии и эбулиоскопии позволяют определить молярную массу недиссоциирующих при растворении веществ по понижению температуры замерзания и повышению температуры кипения растворов известной концентрации: M = K∙1000∙m/Δt ∙m1, где т – масса вещества (г), М – молярная масса, т1 – масса растворителя.
Способы выражения концентрации растворов:
1. Массовая доля (ω) – отношение массы растворенного вещества (mB) к массе раствора (mP):
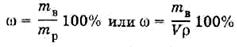
2. Мольная доля (N) – отношение количества растворенного вещества (или растворителя) к сумме количеств всех веществ, составляющих раствор.
N2= n2 / (n1 + n2) или N1= n1 / (n1 + n2) (моль),
где n1 и n2 – соответственно количества вещества растворителя и растворенного вещества.
3. Молярная концентрация (СМ или М) – отношение количества растворенного вещества (n), содержащегося в 1 л раствора (V):
СМ = n / V = m / (M·V) (моль/л),
Раствор, в 1 л которого содержится 1 моль растворенного вещества, называется одномолярным (обозначается 1 М); 0,1 моль растворенного вещества, называется децимолярным (обозначается 0,1 М); 0,01 моль растворенного вещества, называется сантимолярным (обозначается 0,01 М).
4. Моляльность или моляльная концентрация (Сm) – отношение количества растворенного вещества (n), приходящееся на 1000 г растворителя:
Сm = n ∙ 1000 / m1 = m2 ∙ 1000 / (М ∙ т2) (моль/кг),
где т1 – масса растворителя, т2 – масса растворенного вещества, М – молярная масса растворенного вещества.
5. Нормальность или нормальная (эквивалентная) концентрация (СН или Н) – отношение числа эквивалентов (Э) или эквивалентных масс (mЭ) растворенного вещества к объему раствора:
СН = m / (mЭ ∙ V) или СН = m / (М ∙ Э ∙ V) (моль/л; г∙экв/л),
где m – масса растворенного вещества, mЭ – эквивалентная масса растворенного вещества, V – объем раствора, Э – эквивалент, М – молярная масса растворенного вещества.
Вещества реагируют в эквивалентных количествах. Объемы растворов реагирующих веществ обратно пропорциональны их нормальностям:
V1 / V2 = CH2 / CH1 или V1 / V2 = Н2 / Н1
где V1 и CH1 (Н1)– объем и нормальность первого раствора, V2 и CH2 (Н2)– объем и нормальность второго раствора.
Сравнение формул для определения молярной и нормальной концентраций
СМ = n / V = m / (M ∙ V)
СН = m / (М ∙ Э ∙ V)
показывает, что если эквивалент растворенного вещества Э = 1 моль, СМ = СН. Эквивалент, равный единице, имеют растворы одноосновных кислот (HCl, HNO3 и т.д.), однокислотных оснований (NaOH, KOH и т.д.), солей катион и анион которых однозарядные (KCl, NaNO3 и т.д.). Если же эквивалент растворенного вещества не равен 1 моль, то формула соотношения молярной и нормальной концентраций имеет вид: СМ = СН · Э.
Оборудование и реактивы: Ареометры, бюретки (50 мл), колбы (250 мл), мерные цилиндры, пипетки (20–25 мл), пробирки, стеклянные трубки, спиртовка, спички, термометры, технические весы с разновесами, штатив, химические стаканы; гидроксид натрия NaOH (к), хлорид натрия NaCl (к), нитрат аммония NH4NO3 (к), хлорид кальция CaCl2 (к); растворы: серная кислота H2SO4 (разб.) или соляная кислота HCl (разб.), хлорид натрия NaCl (10%), титрованный гидроксид натрия NaOH (0,1 М), охладительная смесь (лед + NaCl).
 2015-06-14
2015-06-14 380
380







