Теоретическим фундаментом науки о процессах и аппаратах химической технологии являются следующие законы природы:
- законы сохранения массы, энергии и импульса;
- законы термодинамического равновесия;
- законы переноса массы, энергии и импульса;
Множество всех материальных объектов условно разбивают на систему и окружающую среду. Система (целое, составленное из частей) – множество элементов, находящихся в отношениях и связях друг с другом, образующих определенную целостность, единство.
Система, полностью лишенная возможности взаимодействовать с окружающей средой, называется изолированной. Система, которая обменивается с окружающей средой веществом и энергией, называется открытой.
Все физические величины, используемые для количественной характеристики системы, называются ее свойствами (параметрами).
Свойства системы, являющиеся суммой соответствующих свойств подсистем, называются экстенсивными (или аддитивными). Это масса, энтропия, теплота, энергия, количество движения (импульс), объем, электрический заряд и.т.д.
Свойства системы, не являющиеся суммой соответствующих свойств подсистем, называются интенсивными (неаддитивными). Это температура, давление и химический потенциал.
Любой экстенсивный параметр системы является субстанцией.
Различают три фазы: твердую, жидкую и газообразную.
Каждая система по своему составу может быть либо гомогенной системой или фазой, либо гетерогенной системой.
Гомогенной фазой называется вещество, физические и химические свойства которого во всех частях его объема одинаковы. Составляющие гомогенной системы перемешаны на молекулярном уровне. Например, смеси газов, жидкие и твердые растворы.
Фаза имеет четкую границу раздела, называемую межфазной поверхностью, отделяющую ее от других фаз. На межфазной поверхности происходит скачкообразное изменение свойств системы. Гетерогенные системы состоят из нескольких фаз, каждая из которых отделена от другой фазы межфазной поверхностью.
Гетерогенные двухфазные системы, которые распространены в химической технологии, состоят из фазы, преобладающей в системе по объему, и называемой дисперсионной (сплошной) средой, и фазы, присутствующей в меньшем количестве и называемой дисперсной фазой.
2.1.2 Механизмы переноса субстанций.
Можно выделить три механизма переноса субстанций: молекулярный, конвективный и турбулентный.
Молекулярный механизм.
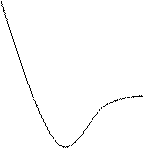
Молекулярный механизм переноса субстанции обусловлен тепловым движением молекул, взаимодействие между молекулами грубо можно представить как “жесткое” отталкивание на малых расстояниях между их центрами 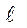 и “мягкое” притяжение на больших. На рис.2.1 представлено изменение потенциальной энергии межмолекулярного взаимодействия
и “мягкое” притяжение на больших. На рис.2.1 представлено изменение потенциальной энергии межмолекулярного взаимодействия 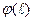 в зависимости от
в зависимости от 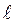 .
.
Сила взаимодействия 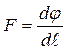 до
до 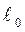 отрицательна (отталкивание) и при
отрицательна (отталкивание) и при 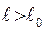 положительна (притяжение). Кинетическая энергия молекул связана с температурой системы:
положительна (притяжение). Кинетическая энергия молекул связана с температурой системы:
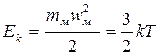 (2.1.)
(2.1.)
Здесь 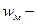 средняя скорость молекул;
средняя скорость молекул; 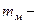 масса молекул.
масса молекул.
Например, для кислорода при 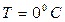
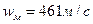 .
.


 |

 |
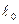
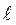
В газах молекулы движутся хаотически, без взаимодействия друг с другом (свободный пробег). При понижении температуры системы уменьшается кинетическая энергия. Они теряют возможность преодолевать силы межмолекулярного взаимодействия и система, конденсируясь, переходит из газового состояния в жидкое. Возрастает роль межмолекулярного взаимодействия. При дальнейшем понижении температуры система переходит в кристаллическое состояние - образуется структура кристаллической решетки. Преобладающим является тепловое движение молекул внутри ячейки.
Молекула, перемещаясь из одной точки пространства в другую, переносит все три вида субстанции – массу, импульс и энергию. В условиях равновесия макроскопический перенос субстанций не наблюдается, так как перенос молекул в любом направлении равновероятен. В отсутствии равновесия появляется межмолекулярный перенос массы в направлении от больших значений концентрации к меньшим, импульса - от больших значений скоростей к меньшим, энергии – от больших температур к меньшим.
Перенос массы осуществляется только за счет поступательного переноса молекул, т.е. за счет непосредственного перемещения из одной точки пространства в другую.
Перенос импульса и энергии происходит как за счет поступательного переноса, так и за счет взаимодействия молекул (модель – сталкивание твердых шаров). При сталкивании молекул происходит изменение их скоростей, что приводит к так называемому столкновительному переносу импульса и энергии. В газах перенос импульса и энергии, в основном, за счет поступательного переноса, а в жидкостях, в основном, за счет столкновения молекул.
 2015-06-14
2015-06-14 1628
1628
