1. Основные характеристики растворов и дисперсных систем. Общие понятия о растворах и дисперсных системах. Классификация дисперсных систем.
Способы выражения состава растворов. Растворимость. Изменение энтальпии и энтропии при растворении. Свойства растворов неэлектролитов. Плотность и давление паров растворов. Законы Рауля и Вант-Гоффа. Фазовые превращения в растворах. Осмотическое давление. Химический, физический и физико-химический анализ.
2. Водные растворы электролитов. Особенности воды как растворителя. Электролитическая диссоциация; степень электролитической диссоциации, константа диссоциации. Свойства растворов электролитов. Сильные и слабые электролиты. Электролитическая диссоциация комплексных соединений.
Ионные реакции и равновесия. Произведение растворимости. Электролитическая диссоциация воды. Ионное произведение воды. Водородный показатель среды. Гидролиз солей. Индикаторы. Теории кислот и оснований. Амфотерные электролиты.
3. Твердые растворы. Образование твердых растворов. Виды твёрдых растворов. Свойства различных твердых растворов.
4. Гетерогенные дисперсные системы. Агрегативная и кинетическая устойчивость гетерогенных дисперсных систем. Образование гетерогенных дисперсных систем.
Грубодисперсные системы – суспензии, эмульсии, пены. Поверхностно-активные вещества и их влияние на свойства дисперсных систем.
Структура и электрический заряд коллоидных частиц. Свойства лиофобных и лиофильных коллоидных систем. Образование и свойства гелей.
5. Электрохимические системы. Окислительно-восстанови-тельные реакции; составление уравнений окислительно-восстанови-тельные реакций. Гетерогенные окислительно-восстановительные и электрохимические процессы. Законы Фарадея.
Понятие об электродных потенциалах. Гальванические элементы. Электродвижущая сила и ее измерение. Стандартный водородный электрод и водородная шкала потенциалов. Потенциалы металлических, газовых и окислительно-восстановительных электродов. Кинетика электродных процессов. Поляризация и перенапряжение. Концентрационная и электрохимическая поляризация.
Первичные гальванические элементы, электродвижущая сила, напряжение и емкость элементов. Топливные элементы. Вторичные источники электрической энергии. Аккумуляторы.
Электролиз. Последовательность электродных процессов. Выход по току. Электролиз с нерастворимыми и растворимыми анодами. Практическое применение электролиза: получение и рафинирование металлов, нанесение гальванических покрытий. Получение водорода, кислорода и других продуктов.
6. Коррозия и защита металлов. Основные виды коррозии. Вред, наносимый коррозией народному хозяйству. Классификация коррозионных процессов. Химическая коррозия металлов. Электрохимическая коррозия металлов.
Борьба с коррозией металлов. Изыскание коррозионно-стойких материалов. Методы защиты металлов от коррозии. Изоляция металлов от агрессивной среды; защитные покрытия. Электрохимические методы защиты (протекторная, катодная и анодная защита). Изменение свойств коррозионной среды; ингибиторы коррозии. Экономическое значение защиты металлов от коррозии. Химические свойства материалов, применяемых в машиностроении.
КОНТРОЛЬНЫЕ ВОПРОСЫ К ЭКЗАМЕНУ
1. Введение в химию. Основные определения и понятия. Значение химии в машиностроении и в охране окружающей среды.
2. Важнейшие классы неорганических соединений. Бинарные и многоэлементные соединения. Оксиды: определение, классификации, номенклатура, получение.
3. Кислоты: определение, классификации, номенклатура, получение, применение.
4. Основания: определение, классификации, номенклатура, получение, применение.
5. Соли: определение, классификации, номенклатура. Способы получения, применение.
6. Основные законы химии: фундаментальные и стехиометрические.
7. Химическая термодинамика. Основные понятия. Энергетика химических процессов. Внутренняя энергия и ее изменение в ходе химической реакций (переходе системы из одного состояния в другое). Первый закон термодинамики.
8. Тепловые эффекты химической реакции. Закон Гесса и следствие из него.
9. Энтальпия вещества или системы. Энтропия вещества или системы, как мера беспорядка расположения в них частиц. Изобарный потенциал (энергия Гиббса) реакции и его изменение в ходе реакции.
10.Выявление расчетом термодинамических параметров принципиальных возможностей, направления и предела протекания хим. реакции.
11.Скорость химической реакции и методы ее регулирования. Зависимость скорости реакции от природы и концентраций реагентов. Закон действующих масс (ЗДМ) для гомогенных и гетерогенных реакций. Колебательные реакции.
12.Зависимость скорости химической реакции от температуры. Уравнение Аррениуса. Правило Вант-Гоффа. Энергия активации.
13.Уравнения Аррениуса. Зависимость скорости хим. реакции от наличия катализатора. Механизм действия катализатора. Каталитические системы.
14.Химические реакции необратимые и обратимые. Состояние химического равновесия. Закон действующих масс для обратимых гомогенных и гетерогенных химических реакций.
15.Химическое и фазовое равновесие. Смещение химического равновесия. Принцип Ле-Шателье.
16.Константа химического равновесия и ее связь с изменением изобарного потенциала. Выявление возможности протекания реакции в данном направлении.
17.Способы выражения состава растворов (концентрации).
18.Растворы; их характеристика и классификация. Растворы электролитов и неэлектролитов. Процесс растворения.
19.Свойства разбавленных растворов неэлектролитов. Понижение давления насыщенного пара растворителя над раствором. Осмос и осмотическое давление.
20.Свойства разбавленных растворов неэлектролитов. Повышение температуры плавления и понижение температуры кристаллизации раствора. Антифризы.
21.Свойства разбавленных электролитов (i, 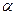 и Кд слабого электролита в растворе). Уравнение Вант-Гоффа и Рауля для растворов слабых электролитов.
и Кд слабого электролита в растворе). Уравнение Вант-Гоффа и Рауля для растворов слабых электролитов.
22.Дисперсные системы. Классификация коллоидных систем. Мицеллы и их строение.
23.Методы получения и разрушения колодных систем. Правила коагуляции электролитами.
24.Электролитическая диссоциация воды. Ионное произведение воды. Водородный и другие показатели среды и методы их определения.
25.Обменные реакции в растворах электролитов. Условия необратимости реакций.
26.Гидролиз солями. Простой (обратимый) гидролиз. Сложный (необратимый) гидролиз.
27.Электрохимические системы. Гальванические элементы. Элек- тродный потенциал. Металлические электроды. Уравнение Нернста.
28.Газовые электроды. Стандартный водородный электрод, его устройство и назначение. Расчет потенциала нестандартного водородного электрода.
29.Изменение величин стандартных электродных потенциалов. Ряд напряжений, определение его возможностей для характеристики химических свойств металлов.
30.Расчет величин электродных потенциалов. Составление и запись схем гальванических элементов; расчет их ЭДС.
31.Концентрационный гальванический элемент, его устройство, химизм работы и расчет его ЭДС.
32.Электролиз. Электролизер, его устройство. Электроды. Электро-лиз расплавов.
33.Электролиз растворов электролитов. Очередность разряда основных частей раствора на электродах при его электролизе.
34.Электролиз раствора соли с инертным анодом; с активным анодом.
35.Законы Фарадея. Выход по току.
36.Практическое применение электрохимических процессов в машиностроение; топливные элементы и аккумуляторы.
37.Применение электролиза в технике. Катодные и анодные процессы. Гальваностегия и гальванопластика, получение и рафинирование металлов.
38.Коррозия металлов и сплавов. Типы коррозийных процессов. Химическая коррозия.
39.Электрохимическая коррозия. Гальванокоррозия и электрокоррозия.
40.Защита металлов от коррозии. Органические и неорганические покрытия.
41.Металлические покрытия. Обработка коррозийной среды. Ингибиторы.
42.Электохимические способы защиты металлов от коррозии. Электрозащита (катодная и анодная защита).
43.Общие свойства металлов. Классификация металлов. Способы получения.
44.Сплавы металлов. Их получение, классификация и применение.
45.Строение атома. Модель Резерфорда-Бора и ее недостатки.
46.Квантово-механическая модель строения атома. Квантовые числа.
47.Порядок заполнения электронами уровней и подуровней. Правила Клечковского, Хунда, принцип Паули.
48.Периодическая система элементов. Кислотно-основные и окислительно-восстановительные свойства веществ. Реакционная способность веществ. Периодический закон.
49.Химическая связь. Комплементарность. Ковалентная связь и способы ее образования. Ионная как предельно полярная ковалентная связь. Металлическая связь.
50.Метод валентных связей. Гибридизация молекул.
51.Основные виды взаимодействия молекул. Силы межмолекулярного взаимодействия.
52.Комплексные соединения. Комплексообразователи, лиганды и координационное число. Типы комплексных соединений.
53.Свойства s -элементов.
54.Свойства р -элементов.
55.Свойства d -элементов.
56.Полимеры и олигомеры. Методы получения полимеров. Полимеризация, поликонденсация. Строение и свойства полимеров. Применение полимеров.
 2015-02-24
2015-02-24 561
561








