Условием кристаллизации является равенство давления насыщенного пара растворителя над раствором давлению пара над твёрдым растворителем. Поскольку давление пара растворителя над раствором всегда ниже, чем над чистым растворителем, это равенство всегда будет достигаться при температуре более низкой, чем температура замерзания растворителя. Так, океанская вода начинает замерзать при температуре около -2° C.
Разность между температурой кристаллизации растворителя T0fr и температурой начала кристаллизации раствора Tfr и есть понижение температуры кристаллизации. Тогда можем сформулировать следуещее следствие из закона Рауля:
понижение температуры кристаллизации разбавленных растворов не зависит от природы растворённого вещества и прямо пропорционально моляльной концентрации раствора:
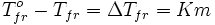 (7.4.2)
(7.4.2)
Здесь: m – моляльность раствора; К – криоскопическая константа, постоянная для каждого растворителя. Для воды К = 1,860, что означает – все одномоляльные водные растворы должны замерзать при темепературе - 1,860С.
Поскольку по мере кристаллизации растворителя из раствора концентрация последнего возрастает, растворы не имеют определённой температуры замерзания и кристаллизуются в некотором интервале температур.
 2015-06-14
2015-06-14 592
592








