Абсолютно нерастворимых веществ нет. Большинство твердых веществ обладают ограниченной растворимостью. В насыщенных растворах электролитов малорастворимых веществ в состоянии динамического равновесия находятся осадок и насыщенный раствор электролита. Например, в насыщенном растворе сульфата бария, находящегося в контакте с кристаллами этого вещества, устанавливается динамическое равновесие:
BaSO4 (т) = Ba2+(р) + SO42- (р).
Для этого равновесного процесса можно написать выражение константы равновесия, учитывая, что концентрация твердой фазы не входит в выражение константы равновесия: Kp = [Ba2+] [SO42-]
Эта величина называется произведением растворимости малорастворимого вещества (ПР). Таким образом, в насыщенном растворе малорастворимого соединения произведение концентраций его ионов в степени стехиометрических коэффициентов равно величине произведения растворимости. В рассмотренном примере
ПРBaSO4 = [Ba2+] [SO42-].
Произведение растворимости характеризует растворимость малорастворимого вещества при данной температуре: чем меньше произведение растворимости, тем хуже растворимо соединение. Зная произведение растворимости, можно определить растворимость малорастворимого электролита и содержание его в определенном объеме насыщенного раствора.
В насыщенном растворе сильного малорастворимого электролита произведение концентраций его ионов в степенях, равных стехиометрическим коэффициентам при данных ионах (при данной температуре), есть величина постоянная, называемая произведением растворимости.
Величина ПР характеризует сравнительную растворимость однотипных (образующих при диссоциации одинаковое количество ионов) веществ. Чем больше ПР данного вещества, тем больше его растворимость. Например:
| Ca(OH)2 | Mg(OH)2 | Fe(OH)2 | |
| ПР | 5,5·10-6 | 5,0·10-12 | 4,8·10-16 |
В данном случае наименее растворимым является гидроксид железа (II).
Условие образования осадка:
[Ky+]x·[Ax-]y > ПР(KxAy).
Данное условие достигают введением одноименного иона в систему насыщенный раствор - осадок. Подобный раствор является пересыщенным относительно данного электролита, поэтому из него будет выпадать осадок.
Условие растворения осадка:
[Ky+]x·[Ax-]y < ПР(KxAy).
Это условие достигают, связывая один из ионов, посылаемых осадком в раствор. Раствор в данном случае - ненасыщенный. При введении в него кристаллов малорастворимого электролита они будут растворяться. Равновесные молярные концентрации ионов Ky+ и Ax- пропорциональны растворимости S (моль/л) вещества KxAy:
[Ky+] = x· S и [Ax-] = y· S
Отсюда
ПР = (x· S)x· (y· S)y = xx· yy· Sx+y
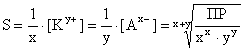
Полученные выше соотношения позволяют рассчитывать значения ПР по известной растворимости веществ (а, следовательно, и равновесные концентрации ионов) по известным значениям ПР при T = const.
 2015-06-14
2015-06-14 9714
9714
