ИОННОЕ ПРОИЗВЕДЕНИЕ ВОДЫ
Вода является очень слабым амфотерным электролитом:
2H2 H3O+ + OH-; 56 кДж.
Свободные ионы водорода H не способны к существованию в водном растворе - они мгновенно гидратируются водой до катионов оксония (H3O+). Однако, для простоты записи часто используют обозначение H+:
H2O H+ + OH-.
Константа диссоциации воды равна:
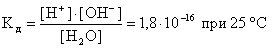
В воде и разбавленных водных растворах электролитов молярная концентрация воды практически постоянна и равна
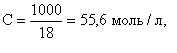
 2015-06-14
2015-06-14 375
375








