Поэтому можно считать постоянным произведение:
KВ·[H2O] = [H+]·[OH-] = 1,8·10-16·55,6 = 1·10-14 (моль/л)
Произведение равновесных концентраций ионов водорода и гидроксила в воде и разбавленных водных растворах (при постоянной температуре) есть величина постоянная - ионное произведение воды (KВ).
KВ = [H+]·[OH-] = 1·10-14 при 25 С
При увеличении температуры KВ значительно возрастает:
| t, С | ||||||
| KВ·1014 | 0,1139 | 0,5702 | 1,0008 | 1,469 | 5,474 | 9,614 |
Следовательно, в чистой воде при 25 ° С
[H+] = [OH-] = 1·10-7 моль/л.
В водных растворах электролитов молярные концентрации ионов H+ и OH- не обязательно равны 10 моль/л (как в чистой воде), но их произведение при 25 С всегда равно 1·10-14. Следовательно, если задано значение [H+], то легко определить и [OH-], и наоборот:
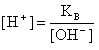
В кислых растворах преобладает концентрация ионов H+:
[H+] > [OH-], т.е. [H+] > 1·10-7 и [OH-] < 1·10-7 моль/л.
В основных растворах преобладает концентрация ионов [OH ]:
[OH-] > [H+], т.е. [OH-] >1·10-7 и [H+] < 1·10-7 моль/л.
Для удобства вместо значений [H+] используют водородный показатель pH. Водордный показатель есть отрицательный десятичный логарифм числового значения молярной концентрации ионов водорода:
|
|
|
pH = -lg[H+]
По аналогии используют гидроксильный показатель (pOH):
pOH = -lg[OH-]
Поскольку KВ = [H+]·[OH-] = const при T = const, то pH + pOH = -lg KВ = f(T).
При 25 С pH + pOH = -lg 1·10-14 = 14, или pH = 14 - pOH.
Величина pH используется как мера кислотности, нейтральности или основности водных растворов:
в кислой среде pH < 7,
в нейтральной среде pH = 7,
в основной среде pH > 7.
 2015-06-14
2015-06-14 698
698








