Применение закона действующих масс к гетерогенной системе - насыщенному раствору сильного малорастворимого электролита, находящемуся в равновесии со своим осадком:
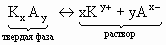
дает выражение константы равновесия:
K = [Ky+]x·[Ax-]y,
которая в данном случае называется произведением растворимости (ПР).
ПР = [Ky+]x·Ax-]y
Таким образом, в насыщенном растворе сильного малорастворимого электролита произведение концентраций его ионов в степенях, равных стехиометрическим коэффициентам при данных ионах (при данной температуре), есть величина постоянная, называемая произведением растворимости.
Величина ПР характеризует сравнительную растворимость однотипных (образующих при диссоциации одинаковое количество ионов) веществ. Чем больше ПР данного вещества, тем больше его растворимость. Например:
| Ca(OH)2 | Mg(OH)2 | Fe(OH)2 | |
| ПР | 5,5·10-6 | 5,0·10-12 | 4,8·10-16 |
 2015-06-14
2015-06-14 515
515








