Коваленттік байланыстың пайда болуы қарапайым молекула – сутек молекуласының түзілуі мысалында жақсы түсіндіріледі:
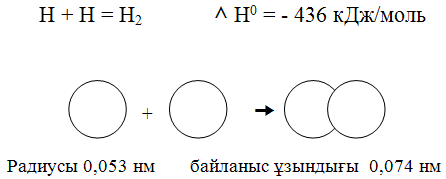
Атомдар жақындасқанда олардың электрондық бұлттары бүркесіп, ядроларының арасындағы кеңістікте максимал электрон тығыздығы бар молекулалық бұлт түзіледі. Ортақ ядролардың тығыз теріс зонаға тартылуы оларды жақындастырады, байланыс ұзындығы 0,074 нм және тұрақты сутек молекуласын түзіліп, энергия ұтымына әкеледі.
Қарама-қарсы спиндері бар жұптаспаған екі s- электрондарының қосылуын кванттық ұяшықтарда сызбанұсқамен былай белгілейді:

Демек, ортақ электрондық жұп есебінен жүзеге асырылатын химиялық байланыты коваленттік байланыс деп атайды.
Коваленттік байланыстың екі түрі бар: полюссіз және полюсті. Коваленттік полюссіз байланыста электрондардың жалпы жұбынан түзілген электрон бұлт – байланыс бұлты (тығыз электрондық аймақ деп аталады) екі атомның ядроларына қатысты кеңістікте симметриялы таралады. Мысалы, бір элементтің атомдарынан тұратын молекулалар: Н2, Cl2, N2, O2, F2 және т.б. Коваленттік полюсті байланыстарда бүркесу зонасы электртерістігі үлкен атомға ығысқан. Мысал ретінде газтектес хлорсутектің түзілуін қарастырайық:
® ® ® ®
Н ® + ® Cl: g Н (:) Cl: немесе Н - Сl
® ® ® ®
Байланыс s- және p- электрондардың ортақ жұптарының түзілу есебінен пайда болады. Коваленттік байланыс электрондық орбитальдардың бүркесу тәсілі бойынша да ерекшеленеді. Коваленттік байланыстың екі маңызды сипаттамасы бар: байланыс ұзындығы және байланыс энергиясы. Байланыс ұзындығы ядроаралық қашықтықтың шамасына сәйкес келеді. Байланыс ұзындығы неғұрылым аз болса, химиялық байланыс соғұрылым берік болады. Байланыс энергиясы молекуладағы бар байланысты үзуге қажет энергияға тең.
Коваленттік байланыс түзілуінің донорлы-акцепторлы механизмдері бар. Донор - бұл бос электрондық бұлты бар атом, ал акцептор- бұл электрон жұбын қабылдауға қабілетті бос орбиталы бар бөлшек.
3 Темір (III) оксидінің Fe2O3 40 грамында қанша грам темір бар екендігін табыңдар
Шешуі:
Темір мен темір (ІІІ) оксидінің молярлық массаларын және массаларын табамыз.
1) Аr(Ғе) =56, М(Ғе)= 56 г/моль,
Ғе2О3 құрамында 2 моль Ғе бар (индекс) бойынша;
m(Ғе) =2 моль* 56 г/моль =112 г
2) Mr (Ғе2О3)=2*Ar(Ғе)+ 3 Ar(O)=2*56+3*16=160
Mr(Ғе2О3)= 160г/моль
m(Ғе2О3)= 1моль*160г/моль=160г
3) 40г темір (ІІІ) оксидінің құрамындағы темірдің массасын табамыз. Ол үшін пропорция құрамыз.
Формула бойынша: 160 г Ғе2О3 құрамында 112г Ғе бар.
Есептің шарты бойынша: 40 г Ғе2О3 ------------ х г Ғе болады.
160/40=112/х пропорцияны шешсек: х=40*112/160=28г
Жауабы: Темір (ІІІ) оксидінің 40 грамында 28 г темір болады.
№3 Билет
1 Атом молекулалық ілімнің қағидаларын мысалдар келтіре отырып осы ілімнің қалыптасуына қай елдің ғалымдарының үлесі болды?
Атом - молекулалық ілім. Дальтонның атом-молекулалық ілім туралы негізгі қағидалары қандай?
XVIII ғасырдың 40-жылдары химия жеке ғылым ретінде қарастырыла бастады. Сол кезде, орыстың ұлы ғалымы М.В.Ломоносов “Математикалық химияның элементтері” атты жұмысында атом-молекулалық көзқарасты алғаш рет ұсынды. Онда былай тұжырымдалған: 1.Барлық заттар корпускулалардан тұрады. 2.Корпускулалар элементтерден тұрады 3.Бөлшектер – молекулалар мен атомдар үнемі қозғалыста болады. 4.Жай заттардың молекулалары бірдей атомдардан, кұрделі заттың молекулалары әр түрлі атомдардан тұрады. Молекула дегеніміз осы заттың химиялық қасиеттерін сақтап тұратын ең кіші бөлшегі. Молекуланың өзі атомдардан тұрады. Атом дегеніміз оң зарятталған атом ядросынан және теріс харятталған электрондардан тұратын электронейтрал бөлшек. Атомдардың массасы, қасиеттері бірімен-бірі әрекеттесуі арқылы күрделі заттар түзілуі, атомдардың арасындағы байланыс XIX ғасырдағы химиктер мен физиктердің зерттейтін жұмысына айналды. Джон Дальтон Химиялық “философияның жаңа жүйесі” атты жұмысында атом-молекулалық көзқарасты талқылайды. Ол сонымен қоса алғаш рет атомдық салмақ деген ұғымды кіргізді. Дальтон өз пікірін былай тұжырымдайды: 1.Барлық зат өте кішкене бөлшектерден – атомдардан тұрады. 2.Жай заттар одан әрі бөлінбейтін бір біріне ұқсас жай атомдардан, ал күрделі заттар күрделі атомдардан тұрады. Күрделі атомдар реакция кезінде жай заттардың атомдарына ажырайды. 3.Күрделі заттың күрделі атомдары әр түрлі жай атомдардың аз ғана санынан құралады. Мысалы: NO, NO2, N2O5 т.с.с. 4.Күрделі атомның массасы оны қоршаушы жай атомның массаларының қосындысына тең. Бұл теорияның Ломоносов теориясынан өзгешелігі жай заттың молекулалары болмайды деген қате тұжырымды шығарған. Алайда Дальтонның сандық сипаттағы масссаны енгізуі үлкен табыс болды.
2 Атомның құрамы және құрылысы 143, 145 бет
1911 жылы ағылшын физигі Резерфордтың атом ортасында оң зарядты ядро, ал оның айналасында электрон бұлтын түзе қозғалатын электрон бар деген теориямен толықтыру.Американ физигі Милликен электрон теріс заряд көрсете- тінін тәжірибе жүзінде дәлелдеп,оны бірге тең деп қабылдады. Атом жалпы электр- бейтарап болғандықтан, электрондар зарядының жалпы саны ядро зарядына тең.
Ал 1913 жылы Резерфордтың шәкірті Г.Мозли атом ядросындағы зарядтардың шамасы элементтің периодтық жүйедегі рет нөміріне тең болатындығын анықтады.
Мозлидің ашқан жаңалығынан кейін Менделеевтің жасаған периодтық жүйесіндегі
Ar–K,Co–Ni,Te–I элементтердің орындарының алмасуы заңды екені анықталды. Осыған байланысты, элементтердің реттік нөмірі атом ядросындағы оң зарядтың санын,сол сияқты ядро айналасында қозғалатын электрондар санын көрсетеді.
Реттік нөмірдің физикалық мәні осында. Элементтердің реттік нөмірі – оның атом ядросының заряды. Атомның ядро заряды химиялық элементтердің қасиеттерін сипаттайтын маңызды шама. Атом құрылысын одан әрі зерттеу кезінде құрамына протондар мен нейтрондар деп аталатын бөлшектер кіретіні анықталды.
Атомның элементар бөлшектері:
| Бөлшектер | Белгісі | Салыстырмалы заряды | Салыстырмалы массасы |
| Протон | р | + | |
| Нейтрон | п | ||
| Электрон | е | − |
1. Элемент атомының массасы протон мен нейтрон массасының қосындысына тең.
2. Ядродағы протон саны элементтің реттік нөміріне тең.
А = Z + N; A – атомдық масса; Z – протон; N – нейтрон;
Табиғатта атомдық массасында айырмашылығы болатын бірдей элементтер атомы болады. Мысалы, хлор элементінің массасы 35 және 37 болатын екі түрі кездеседі. Бұл атомдардың ядросында протондар саны бірдей,ал нейтрондар саны әр түрлі. Олар изо- топтар. Изотоптар – ядро зарядтары бірдей,атомдық массалары әртүрлі атомдардың түр өзгерістері. Изотоп – бірдей орында деген мағнаны білдіреді.
Изотоптарда протон мен электрон саны бірдей, нейтрон сандары әртүрлі. Әрбір изотоп екі түрлі шамамен өлшенеді: массасы және элементтің рет нөмірі. Мысалы:
сутегінің изотоптары, аттары: протий, дейтрий, тритий.
Элементтердің атомдық массалары бөлшек сандармен өрнектеледі. Мысалы, хлор элементінің с.а.м. 35,5. Бұл ұғымдардың айырмашылығын түсіндіру үшін мынадай мысалдар келтіріледі. Табиғаттаизотобы 75%, ализотобы 25% таралған. Осыдан хлор элементінің орташа с.а.массасы шығады: Аr(CI) = 35∙0,75+37∙0,25 = 35,5
3 Алюминий оксидінің Al2O3 қандай массасында 15.5 г алюминий болады
Шешуі:
Mr (Al2O3) = 27*2+3*16= 54+48=102
102/15,5 = 54/ х
х =15,5*54/102= 8,2 г
№4 Билет
 2015-06-04
2015-06-04 8407
8407